Насколько сегодня теплей или холодней, чем вчера? Простейший вопрос, но тысячи лет люди не могли на него толком ответить. К счастью для человечества, зимой 1564 года под сенью знаменитой падающей башни родился Галилей.
Холод – это отсутствие тепла
В середине XVI века не было ещё понятий «термодинамика» и «молекулярно-кинетическая теория». Для понимания температуры требовалось хотя бы элементарно её описывать. Этим занялся Галилео Галилей. Его интересовало всё! Ну какой опыт можно поставить с колбой и тазом воды? А между прочим, из этих частей в 1597 году Галилей составил термоскоп — первый прибор для измерения «жары» и «холода». Эффект проявляется просто: горлышко колбы надо опустить в воду и затем согреть колбу (можно даже руками, главное, чтобы вода была прохладной). По мере остывания воздуха в колбе обнаруживается, что вода поднимается по горлышку всё выше и выше. Бенедетто Кастелли, друг и ученик великого пизанца, в 1638 году писал:
«Этот эффект синьор Галилей использовал для изготовления инструмента для определения степени жары и холода».
Примечательно, что естествоиспытатель в обосновании опыта отметил, что «холод не является положительным качеством, а есть лишь отсутствие тепла, холод пребывает не в материи, а в чувствительном теле», тем самым предвосхитив молекулярно-кинетическую теорию.
А знаете, кто был учеником Кастелли? Э Т, изобретатель барометра (и много ещё чего), учёный, кое в чём превзошедший своих наставников! Так вот: Торричелли довёл идею термоскопа Галилея до практического воплощения, создав так называемый «флорентийский термометр»: в небольшую колбу вместо воды заливались ртуть и подкрашенный спирт, а тонкая трубка-горлышко запаивалась сверху. Получился удобный герметичный прибор.
О ПОЛЬЗЕ ПУТЕШЕСТВИЙ ПО ИТАЛИИ
Термометр попался на глаза Роберту Бойлю. Окончив Итонский колледж, Бойль путешествовал по Италии, а зимой 1641 года несколько месяцев прожил во Флоренции. Это время он посвятил изучению трудов Галилея. Возможно, тогда же он свёл знакомство с кем-то из верных учеников «великого звездочёта»— Кастелли, Торричелли или Винченцо Вивиани — и получил термометр от них.
Как бы то ни было, но домой в Ирландию Роберт Бойль вернулся убеждённым сторонником нового научного подхода, считая, что эксперимент — вот мерило истины. Зримым подтверждением верности галилеевской парадигмы познания стал термометр. В Британии прибор быстро оценили по достоинству. А любимым занятием отпрыска родовитого семейства стали опыты, благодаря которым он остался в памяти как выдающийся физик-экспериментатор и первооткрыватель фундаментального газового закона, хотя сам Бойль считал взаимосвязь объёма и давления всего лишь любопытным свойством воздуха.
ЭКСТРИМ РАДИ ИСТИНЫ
Особое место во «французском ряду» великих учёных принадлежит Жозефу Луи Гей-Люссаку —блестящему физику и химику, талантливому преподавателю и, между прочим, обладателю мирового рекорда высоты — 16 сентября 1804 года на воздушном шаре он достиг высоты в семь с лишним километров! Впрочем, цель у предприятия была несколько иная: учёный проводил целый ряд измерений температуры, влажности, состава атмосферы, напряжённости магнитного поля, наконец, как альпинист высокой квалификации, испытал на себе действие разрежённого воздуха.
Молодой учёный к тому времени уже приобрёл репутацию бескомпромиссного и требовательного исследователя и человека незаурядного мужества.
Физическим законом это «свойство» сделал французский физик Эдм Мариотт сформулировавший его математически и нашедший ему разные применения, например, в методе барометрического определения высоты местности. Кстати, именно Мариотт придумал забавную игрушку, известную нам как «колыбель Ньютона» — она привела в восторг великого английского учёного и описана в его знаменитых «Началах».
Значимость работы Мариотта, опубликованной в 1679 году в Париже, можно сравнить, пожалуй, с изданием «Трактата об электричестве и магнетизме» М (1873) или статьи «К электродинамике движущихся тел» Э (1905), которые совершили революцию в естествознании. Судите сами: газовые законы (законы Бойля—Мариотта, Шарля, Гей-Люссака) проложили прямую дорогу к молекулярно-кинетической теории, термодинамике, статистической физике, без которых было бы невозможно технологическое развитие цивилизации. Тепловые двигатели: паровые машины, моторы внутреннего сгорания, реактивные двигатели — лишь малая толика машин, которые изменили облик нашей цивилизации, сделав доступными самые отдалённые уголки планеты.
В научном созвездии тогдашнего Парижа Гей-Люссак по праву занимал одно из ведущих мест, и многие естествоиспытатели становились мишенями его критических замечаний. Не избежал их и знаменитый путешественник А Г, опубликовавший отчёт о своей американской экспедиции с данными опытов по определению состава воздуха. Отчёт изобиловал ошибками и неточностями, впрочем, простительными для полевых условий. Гей-Люссак не преминул указать на них, не стесняясь в выражениях.
К чести Гумбольдта, исследователь, признав справедливость замечаний по существу, не придал значения излишне резкому тону рецензии. Такая снисходительность помогла сближению замечательных учёных и стала основой их многолетней дружбы, человеческой и научной. Их совместная работа привела к поистине эпохальному открытию— в 1808-м они сформулировали закон объёмных отношений, согласно которому соотношение между объёмами реагирующих газов выражается простыми целыми числами. Вот что написал Александр фон Гумбольдт в примечаниях к рукописи: «В нашем сочинении мы утверждаем, что 100 частей оксигена (кислорода) по объёму требуют для своего насыщения 200 час тей гидрогена (водорода). Б (выдающийся шведский химик Й Я Б) упоминал уже об этом явлении, как об основании всего, что после открыто относительно определённых пропорций; но проницательности Гей-Люссака принадлежит наблюдение полного насыщения. Я участвовал в опытах, но только один Гей-Люссак провидел важность наблюдений для теории».
Какой же вывод можно сделать, особенно приняв во внимание, что в начале XIX века представления о молекулярном строении вещества имели гипотетический характер? Итак, сжигая водород в чистом кислороде, мы получаем водяной пар, при этом объёмы веществ относятся как 2:1:2. Первое предположение: молекулы водорода и кислорода состоят из двух атомов, а вода— из трёх. Тогда верно уравнение:
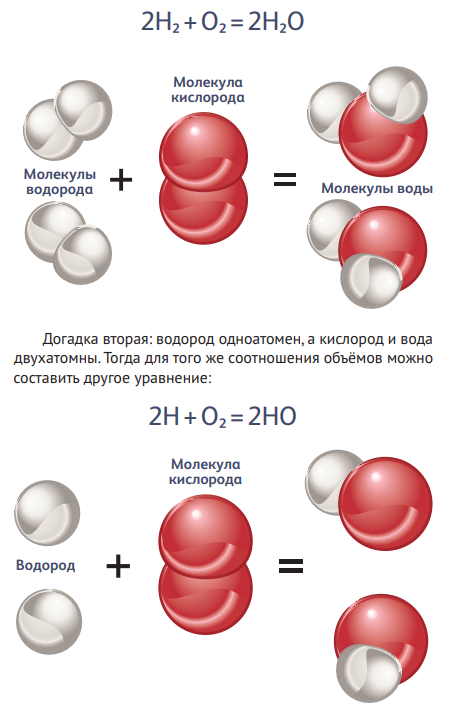
КЛЮЧ В МИКРОМИР
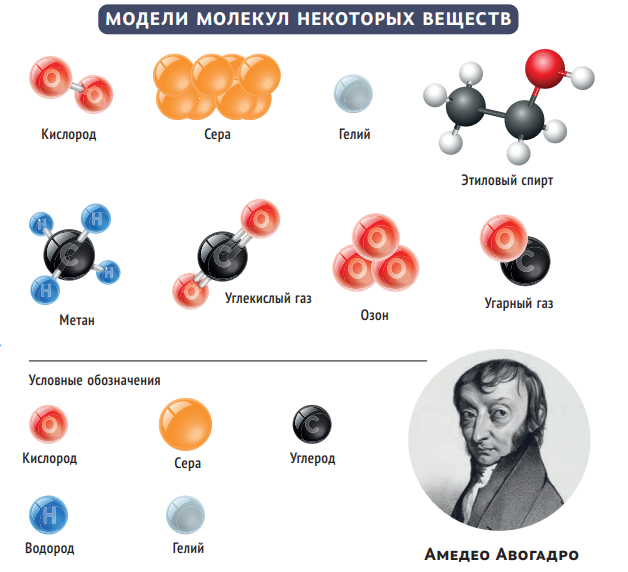
Таким образом, закономерность, описанная Гей-Люссаком, позволяла строить модели молекул разных газов. Именно к этой мысли в 1811 году пришёл итальянский химик А А. Более того, он предположил, что в одинаковых объёмах при равных условиях (давлении и температуре) содержится одно и то же число реагирующих час тиц: «Первая гипотеза, которая возникает в связи с этим и которая представляется единственно приемлемой, состоит в предположении, что число составных молекул любого газа всегда одно и то же в одном и том же объёме… А составные молекулы состоят из более мелких частиц— атомов».
Тремя годами позже учёный опубликовал «Очерк об относительных массах молекул простых тел, или предполагаемых плотностях их газа, и о конституции некоторых из их соединений», в которой исчерпывающе изложил результат долгих размышлений и экспериментов:
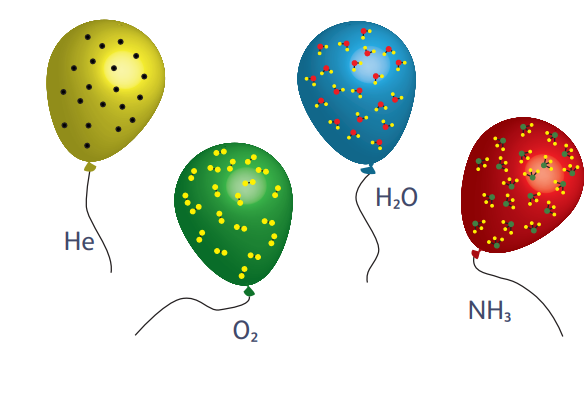
«…равные объёмы газообразных веществ при одинаковых давлениях и температурах отвечают равному числу молекул, так что плотности различных газов представляют собою меру масс молекул соответствующих газов».
Сегодня это определение известно нам как закон Авогадро, хотя справедливее назвать его законом Авогадро—Ампера: великий французский физик практически тогда же пришёл к аналогичным выводам, но отталкивался больше от математических моделей, чем от результатов химических экспериментов.
Закон Авогадро в дополненной формулировке имеет важное следствие: измеряя плотности газов, можно определить относительные массы молекул, составляющих эти газы. Таким образом, взяв при нормальных условиях (то есть при атмосферном давлении и температуре 0 °С) по литру, например, водорода и кислорода, из соотношения их плотностей (0,09 и 1,43 кг/м³ соответственно) можно сделать вывод, что масса частицы водорода примерно в 16 раз меньше, чем у кислорода. Ещё одно существенное уточнение — Авогадро отмечал, что молекулы в газах не обязательно должны состоять из одиночных атомов, а могут содержать несколько атомов, одинаковых или разных.
АВТОРИТЕТ ЗАБЛУЖДЕНИЙ
Удивительно, но теорию Авогадро всерьёз не восприняли, полагая, что это просто экстравагантная гипотеза, которую невозможно доказать на основании имеющихся фактов того времени. «Отец» органической химии, Й Я Б, раскритиковал работу, защищая собственную электрохимическую теорию, согласно которой все атомы имеют заряд, поэтому молекулы могут образовываться исключительно из разнополярных атомов. Следовательно, ни H2, ни O2 существовать просто не могут.
Авторитет Берцелиуса был настолько велик, что никто не указал на серьёзный недостаток его теории — во многих случаях она не соответствовала результатам эксперимента.
Например, окисление азота по электрохимической теории происходит так:
N + O = NO
с соотношением объёмов 1:1:1. На самом же деле получается 1:1:2! И если рассматривать процесс с точки зрения Авогадро, то всё объясняется элементарно:
N2 + O2 = 2NO
ТРИУМФ
Так что на время о законе Авогадро забыли — почти на полвека. Только 3 сентября 1860 года на Международном химическом конгрессе в Карлсруэ итальянский учёный С К распространил среди именитых участников форума брошюру с изложением основных положений разработанной им системы основных химических понятий. Книжка стала результатом глубокого анализа атомно-молекулярных воззрений и практического применения закона Авогадро. Однозначно разграничив понятия «атом», «молекула» и «эквивалент», Канниццаро предложил логичную и стройную систему атомных весов. Фактически работа Канниццаро стала сильнейшим аргументом в пользу химиков-материалистов, считавших изучение атомно-молекулярной структуры вещества принципиально возможным. Немецкий химик Л М, внёсший большой вклад в создание периодической таблицы элементов, писал: «Меня поразила ясность, с которой там говорится о важнейших спорных пунктах. С моих глаз спала пелена, исчезли все сомнения. Взамен появилось чувство спокойной уверенности».
Принятие теории Авогадро придало невероятный импульс научному поиску. Сам исследователь не дожил всего пять лет до триумфа. Химия наконец стала оперировать точными математическими соотношениями; стало возможно определять состав молекул соединений, рассчитывать атомные и молекулярные массы. Теперь химик точно знал, что в 2 граммах водорода и 32 граммах кислорода, взятых при нормальных условиях, содержится одно и то же количество молекул.
Влияние закона Авогадро на развитие химии и физики трудно переоценить. Периодическая система химических элементов, броуновское движение, упругое рассеяние света, молекулярно-кинетическая теория, статистическая физика, термодинамика, постоянная, названная именем Авогадро, и многое другое— все эти открытия и дисциплины, сформировавшие современную картину мира, так или иначе отталкивались от найденной им закономерности. Так продолжилось дело величайшего Галилея.






