Многих учёных-химиков когда-то в детстве эта удивительная наука привлекла яркими спецэффектами: меняющими цвет растворами, яркими искрами фейерверков. Повзрослев, мы привыкли к многоцветью салютов и петард. Многим даже кажется, что в пиротехнике ничего не меняется. Но на самом деле специалисты продолжают искать новые рецепты, причём думают не только о зрелищности — яркости пламени, его цвете и длительности горения,— но и о безопасности, в том числе для окружающей среды.
Химия пиротехники
Сгорая, вещества окрашивают пламя в разные цвета, а в ряде случаев создают дым и характерные звуковые эффекты. Услышав слово «пиротехника», мы, конечно, сразу представляем праздничные салюты. Однако гораздо больший объём этих составов используется вооружёнными силами: сигнальные ракеты или огни дублируют команды, задают цели для авиации и артиллерии или просто освещают нужные районы. Разрабатывая новый состав, необходимо учитывать, насколько он сам и продукты его сгорания опасны для окружающей среды.
Смеси для получения тепла, света, шума и дыма научились составлять несколько тысяч лет назад. За право называться родиной пиротехники до сих пор бьются Индия и Китай. Сложно сказать, где изобрели порох (смесь угля, серы и селитры). Однако Индия, в отличие от Китая, может похвастаться залежами калийной селитры (KNO3), поэтому, скорее всего, вопреки распространённому мнению порох придумали не в Поднебесной. Первым европейским пиротехническим составом считается греческий огонь. Наиболее раннее упоминание о нём относится к V веку до н. э. Точный рецепт греческого огня неизвестен, а вот для пороха, пришедшего из Азии в Европу к 1560 году, было найдено оптимальное соотношение компонентов. Его придерживаются по сей день: 75 частей калийной селитры, 15,6 части древесного угля и 9,4 части серы.
Первое письменное свидетельство об огненном празднестве по случаю встречи Нового года в Китае восходит к 1200-м годам. Дворцовая бухгалтерия зафиксировала, что на увеселения с помощью горящего пороха казна потратила около 100 килограммов серебра. В Европе пороховые фейерверки запускали при французском дворе начиная с XVII века, в Россию огненные забавы привёз Пётр Первый. Удовольствие от созерцания огней омрачал выделяющийся при сгорании пороха сернистый газ с резким неприятным запахом. Нам эти фейерверки вообще не особо понравились бы: они горели всего одним цветом — жёлтым. Температуры горения было недостаточно для создания пламени разных цветов. Поэтому если в фильме о событиях, предшествующих Наполеоновским войнам, вы видите разноцветные огни, значит, создатели картины сэкономили на исторических консультантах или пожертвовали достоверностью ради зрелищности.

Как покрасить пламя
Что делает огни красочными? Когда атом получает достаточное количество энергии, внешние электроны переходят на более высокие энергетические уровни. Но им невыгодно оставаться там, поэтому через некоторое время они возвращаются, отдавая при этом окружающей среде энергию в виде электромагнитного излучения с определённой длиной волны, говоря проще — окрашенного света.
Энергии, выделяющейся при горении пороха, было недостаточно для возбуждения электронов: селитра оказалась слабым окислителем для высокотемпературного горения. Цветными фейерверки начали становиться в конце XVIII века, после того как в 1780 году французский химик Луи Бертолле получил окислитель сильнее селитры — хлорат калия (KClO3), также известный как бертолетова соль.
Бертолетова соль создавала достаточно высокую температуру для возбуждения электронов. В результате пламя становилось разноцветным. Совершенствуя пиротехнические составы, учёные открыли более эффективные окислители, а изучение влияния металлов на цвет пламени привело к созданию различных видов спектрального анализа.
ОТКУДА БЕРУТСЯ ОГНИ ФЕЙЕРВЕРКА?
При нагревании, электроны в ионах металла получают заряд энергии и могут перейти на более высокий уровень. Сразу после этого падают обратно на прежний уровень, испуская энергию в виде электромагнитного излучения. В зависимости от металла варьируется цвет излучения.
Сейчас цветные огни фейерверков и сигнальных ракет получают главным образом сжигая пиротехнические составы, содержащие соли щелочных и щелочноземельных металлов. Жёлтую окраску огням придают соли натрия, жёлто-зелёную — бария, за фиолетовое окрашивание отвечает калий.
Традиционно композиции для красных огней включают соли стронция и хлорсодержащие органические вещества. Чаще всего в состав входит нитрат стронция (Sr(NO3)2) и поливинилхлорид — связующий компонент и источник хлора. При высоких температурах эти вещества реагируют с образованием метастабильного хлорида стронция (SrCl). Он горит ярко-красным цветом, который не пугает зрителей, однако вызывает озабоченность у экологов и государственных организаций, курирующих вопросы безопасного применения химических веществ.
Дело в том, что при горении пиротехнических составов Sr(NO3)2/поливинилхлорид образуются канцерогены, наиболее опасными из которых являются хлорсодержащие диоксины — сильнейшие яды (смертельная доза 2,3,7,8-тетрахлородибензо-п-диоксина в 150 000 раз меньше смертельной дозы цианистого калия). Ещё одна опасность этих соединений в том, что в окружающей среде они практически не разлагаются, а попадая в организм, не выводятся и накапливаются в жировой ткани.
ОКИСЛИТЕЛИ
В настоящее время вместо хлората калия и других хлоратов в качестве окислителей пиротехнических составов используются перхлораты, например перхлорат калия — KClO4. Эти соединения содержат больше кислорода и окисляют топливо эффективнее, при этом их гораздо менее опасно хранить и применять.
Горение без последствий
Таким образом, встал вопрос о разработке новых пиротехнических составов, которые горели бы красным пламенем без выделения хлорорганических продуктов.
В 2011 году химики Джесс Сабатини и Томас Клапотке изобрели экологически безопасный состав, позволяющий пиротехническим смесям гореть зелёным пламенем: учёные предложили заменить соли бария, ионы которого токсичны для человека и окружающей среды, на безопасный карбид бора B4C. Он даёт даже более яркий и насыщенный цвет.
Основа нового состава — тригидрат дилитиевой соли 3,3’-диамино-4,4’-динитроамино-5,5’-бис-1,2,4-триазолят (Li2ANAT). Соль Li2ANAT синтезируется в три стадии. Она отличается высокой температурой разложения (240 °С), а значит, её применение безопасно. Кроме того, соль не поглощает пары воды из окружающей среды (поглощение воды ухудшает горючие свойства). Соединение Li2ANAT одновременно является окислителем и компонентом, придающим пламени окраску. Такое сочетание свойств в одном веществе позволяет уменьшить число компонентов в пиротехнических составах.
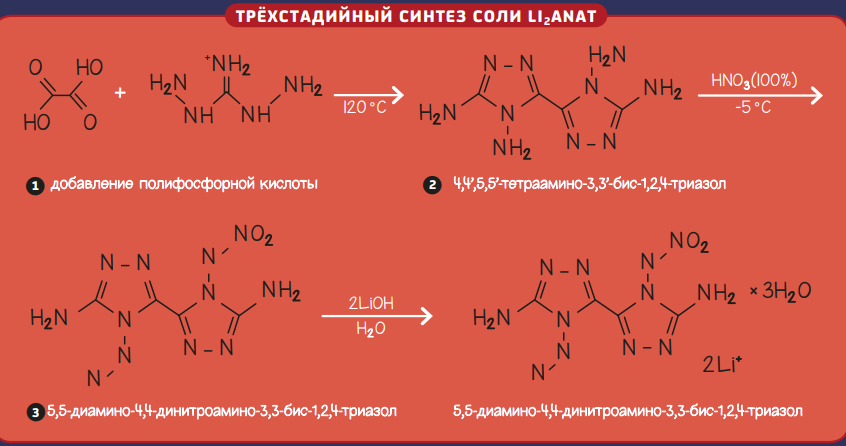
Исследования показали, что пиротехнические композиции, в состав которых входили выполняющие роль топлива порошок магния и уротропин, эпоксидное связующее, соль Li2ANAT и дополнительный окислитель нитроцеллюлоза, горят устойчивым красным пламенем за счёт наличия ионов лития. Молекулы кристаллизационной воды в составе Li2ANAT не влияют на горение и цвет пламени.
Для промышленного применения соли Li2ANAT необходимо решить ряд проблем, и в первую очередь оптимизировать световую отдачу: модельный состав на основе лития давал меньше света, чем содержащие стронций. Тем не менее это первая пиротехническая смесь, которая даёт красное пламя и свободна от перхлоратов, галогенсодержащих веществ и производных стронция. Учёные Сабатини и Клапотке надеются, что в ближайшее время им удастся подобрать правильное соотношение ингредиентов литийсодержащего пиротехнического состава. Он будет интересен как производителям фейерверков, так и изготовителям сигнальных огней и ракет. Возможно, краснопламенные фейерверки станут безопасны для людей и окружающей среды.
ПРОШЛОЕ И БУДУЩЕЕ ПИРОТЕХНИЧЕСКИХ СОСТАВОВ
Смеси на основе солей стронция и полихлорвинила при сгорании дают опасные полихлорсодержащие органические вещества (слева); при сгорании новой литийсодержащей соли вредные вещества не образуются (справа). Составы дают красное пламя одинакового оттенка.






