Вода — самое привычное вещество на Земле. Мы сталкиваемся с ней каждый день, каждый шаг нас сопровождает это обыкновенное химическое вещество.
Но что мы на самом деле знаем о воде? Может, мы настолько привыкли к ней, что не замечаем её уникальных особенностей?
Например, молекула воды состоит из атомов водорода и кислорода. Простая молекула кислорода (О2) поддерживает горение, молекула водорода (Н2) — легко горючее вещество. Газовая смесь этих двух веществ очень взрывоопасна. Однако, молекула, полученная из этих двух элементов, используется для тушения огня!
Некоторые живые организмы состоят на 99% из воды (например: медузы). В человеческом организме наиболее богатый водой орган — это мозг (90%). Орган, который управляет всеми химическими процессами внутри тела. При уменьшении общего количества воды в организме на 2% мы чувствуем жажду, при потере 10% воды у человека начинаются галлюцинации, а потеря 20% приводит к смерти. Получается, чем меньше воды, тем нам труднее жить. В таком случае можно утверждать, что с биологической точки зрения вода — это основа жизни. По мере старения организма количество воды в ней уменьшается, жизнь уходит вместе с водой. Так какой должна быть вода пригодная для жизни? Ошибочно думать, что вода должна быть абсолютно чистой. Если бы мы пили абсолютно чистую (без примесей) воду, то она бы вымывала все жизненно необходимые минералы и витамины из нашего организма. Ведь вода — самый мощный растворитель в природе.
Вода — лучший растворитель
Способность воды растворять вещества используется повсеместно, начиная от растворения сахара в чае до извлечения различных концентратов и минералов из почвы. На производстве драгоценные металлы из почвы отделяются путём растворения их солей в воде, для устранения пятен на одежде мы замачиваем вещи в воде, для приготовления пищи мы также используем воду. Так что же происходит на самом деле при растворении? Почему вода — универсальный растворитель?
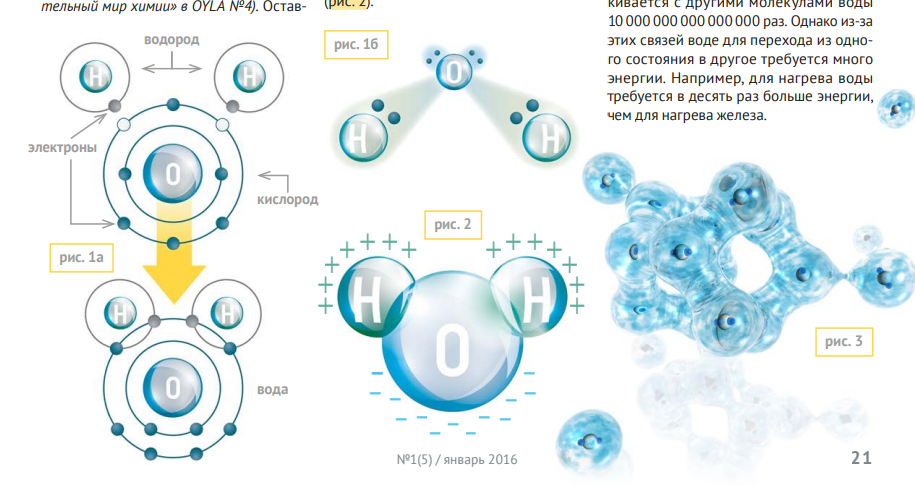
Вам уже известно, что молекула воды состоит из атомов водорода и кислорода. Единственный электрон на внешнем энергетическом уровне атома водорода образует с одним электроном кислорода ковалентную связь (см. статью «Удивительный мир химии» в OYLA №4). Оставшийся электрон кислорода образует ещё одну ковалентную связь с ещё одним атомом водорода. Так получается молекула H2 O (рис. 1а).
Но как это связано со способностью растворять? Дело в том, что структура её молекулы не линейна из-за наличия несвязанных электронов у атома кислорода, которые мешают связям Н-О выровняться (рис. 1б). А сама молекула сильно поляризована. Из предыдущих номеров нашего журнала вы знаете, что атом кислорода обладает намного большим сродством к электрону, чем атом водорода. Поэтому ковалентная связь смещена в сторону кислорода. Это является причиной поляризованности молекулы воды (рис. 2). Поляризованные молекулы воды ассоциируются в кластеры из четырёх и более молекул (рис. 3). Активные молекулы в кластерах взаимодействуют с растворяемыми веществами, образуя системы с переносом заряда. При этом растворяемое вещество не разрушается. Например, если в воде растворить соль, то её можно получить обратно выпариванием воды.
Связи между молекулами называются водородными связями. Эти связи слабее, чем ковалентные. Они беспрерывно разрываются и создаются вновь: за секунду каждая молекула воды сталкивается с другими молекулами воды 10 000 000 000 000 000 раз. Однако из-за этих связей воде для перехода из одного состояния в другое требуется много энергии. Например, для нагрева воды требуется в десять раз больше энергии, чем для нагрева железа.
Теплоёмкость воды
Важным физическим параметром воды является её теплоёмкость. Она аномально большая по сравнению с другими жидкостями. Эта характеристика показывает количество теплоты, которое вода способна поглотить, она помогает поддерживать устойчивый климат на нашей планете. Эта особенность воды защищает поверхность Земли от перегрева под воздействием солнечных лучей днём и от переохлаждения ночью, так как накопленную днём теплоту вода ночью обратно сообщает воздуху. По этой причине лёд плавает на поверхности воды, защищая её от полного замерзания. Ледники в океанах выступают в роли ледяной «шубы», которая защищает морских обитателей от замерзания и гибели. Формула плотности: (где ρ (ро) — плотность, m — масса, она постоянна, а V — объём). ρ = m V
Поэтому климат прибрежных регионов является мягким, а далёкие от океанов и морей местности обладают резко континентальным климатом. Например, в степях летом днём бывает очень жарко, а ночью — холодно. Если бы океаны состояли, к примеру, из масла, то днём температура была бы вдвое выше, а ночью — вдвое холоднее, не учитывая другие побочные эффекты.
Плотность
Не менее важной физической характеристикой воды является её плотность. Максимальная плотность у воды 1 кг/л при температуре 4ºС. Из курса физики вы знаете, что при нагревании и испарении жидкости её плотность уменьшается, а при замерзании — увеличивается. В случае с водой это правило не работает. Плотность льда меньше, чем у жидкой воды, то есть при замерзании её объём увеличивается.

По этой причине лёд плавает на поверхности воды, защищая её от полного замерзания. Ледники в океанах выступают в роли ледяной «шубы», которая защищает морских обитателей от замерзания и гибели.
Способность воды расширяться используется людьми давно. Так, например, в древности добывались строительные материалы из скал. В щели камней перед заморозками заливалась вода, а она, расширяясь, разбивала скалы. По той же причине после морозной зимы приходится нередко заменять асфальтовые автодороги из-за появившихся трещин.
Мягкая вода может разрушать, оттачивать камни, пробивать скалы. Все мы знаем, насколько острыми бывают камни на водопадах и в горных речках. Всё это — последствия воздействия воды. Разрушительная сила воды помогает ростку с лёгкостью пробить скалу. Воде можно легко придать форму, но это единственная стихия в природе, способная придавать форму скалам. И хотя вы без труда можете опустить руку в воду, сжать её в три раза труднее, чем сжать алмаз, а удариться на большой скорости о воду — это всё равно, что влепиться в бетон.
Поверхностное натяжение
Вода обладает наибольшим поверхностным натяжением среди жидкостей (кроме ртути). Этот параметр характеризует энергию взаимодействия молекул на поверхности жидкости. Чем выше энергия, тем сложнее разорвать эти связи. Если бы поверхность воды не была такой «прочной», она бы не смогла подниматься по стволу дерева к листьям, преодолевая сотни сантиметров, насекомые не могли бы перемещаться по поверхности озёр, а жидкость в водоёмах очень легко испарялась бы. Поверхностное натяжение воды можно снижать путём растворения в ней солей. Вода с растворёнными минералами имеет поверхностное натяжение ниже, чем чистая вода, что облегчает её усвоение. Это ещё одна причина, почему нельзя пить абсолютно чистую воду.
Все перечисленные свойства воды аномальны и являются исключением из правил, но только они делают Землю пригодной для жизни. Не будь хоть одного из многих десятков особенностей воды, мы не смогли бы выжить на нашей планете. Последние десятилетия научно-технический прогресс нанёс значительный урон водному балансу в природе. Миллионы тонн углекислого газа, выбрасываемого в воздух, вызывают парниковый эффект, что вызывает глобальное потепление.
Таяние ледников привело к увеличению жидкой воды на Земле, что и вызвало агрессивное поведение океанов и морей. К счастью, на сегодняшний день принимаются меры по уменьшению выбросов углекислого газа и переходу к зелёной экономике. Это очень важный шаг! Ведь вода бесценна, чем бережнее мы к ней будем относиться, тем легче будет жить.






