Ответ на этот вопрос нужно искать в особенностях электронного строения атомов, из которых они состоят. Атомы как кирпичики мироздания, соединяясь и разъединяясь, позволяют материи менять свои характеристики — форму, цвет, вкус и так далее.
ЕСЛИ ПОСМОТРЕТЬ НА ЖЕЛЕЗНУЮ ЛОЖКУ И КУСОК СЫРА В ЭЛЕКТРОННЫЙ МИКРОСКОП, мы увидим, что они состоят из разных атомов (рис. 1): которые имеют разные размеры, плотность электронных облаков, свечение и так далее. (Читайте статью о строении атома — Неделимый — 24 стр.). Все химические и физические свойства атомов — это следствие взаимодействия электронов атома с окружающим миром.
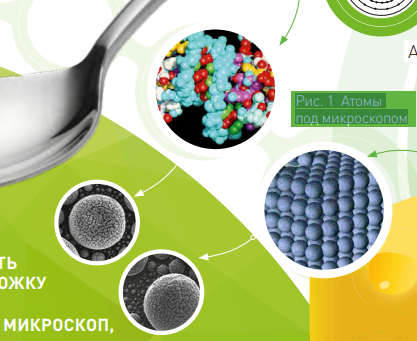
Количество и способы размещения электронов разнятся от атома к атому. Орбитали* атома один за другим заполняются электронами. С увеличением количества электронов увеличивается количество энергетических уровней и, как следствие, количество орбиталей. (Рис. 2)

ЧТО ТАКОЕ ОРБИТАЛИ?
Энергетические уровни электронов похожи на кольцевые автодороги в мегаполисах. Чем они ближе к центру, тем меньше в них автомашин. Также и энергетические уровни, находящиеся дальше от ядра, вмещают больше электронов.
Подобно тому, как автодороги делятся на полосы, энергетические уровни делятся на орбитали. В зависимости от формы орбитали могут содержать от 2 до 14 электронов. Существуют сферические s-орбитали, вмещающие 2 электрона, гантелеобразные p-орбитали, вмещающие 6 электронов, а также более сложные d- и f- орбитали, вмещающие 10 и 14 электронов, соответственно.
КАК ТАК ПОЛУЧАЕТСЯ?
Химические элементы в периодической системе расположены по количеству протонов в ядре, которое для нейтрального атома равно количеству электронов. Поэтому с увеличением количества электронов их легче оторвать от атома (рис. 4). В пределах периода (горизонтальные линии) радиусы атомов одинаковы, и действует правило заполняемости энергетических уровней (см. рис. 2)
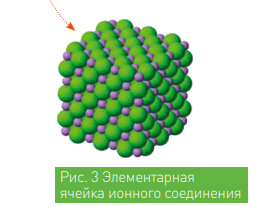
Увеличение количества орбиталей приводит к увеличению радиуса атома, а значит, электрон, находящийся на внешней орбитали (валентной орбитали), можно легче оторвать, так как он находится дальше от ядра, где сила притяжения меньше. И наоборот, чем меньше радиус, тем сложнее оторвать валентный электрон. Однако это не всегда верно. Нужно учитывать также и тип электронного строения атома. Сравним, к примеру, два атома: атом лития и атом хлора. У лития 3 электрона, конфигурация имеет вид: Li3 2)1), итого 2 энергетических уровня 1 валентный электрон. Хлор имеет 17 электронов с конфигурацией Cl17 2)8)7), всего 3 уровня и 7 валентных электронов! Радиус атома лития меньше чем радиус атома хлора, однако хлор имеет почти законченную электронную конфигурацию, а у лития всего один валентный электрон на внешнем энергетическом уровне, и он гораздо подвижнее. Поэтому электрон легче забрать у атома лития. При взаимодействии вышеназванных атомов, атом лития теряет свой электрон, то есть приобретает положительный заряд, а атом хлора принимая электрон становится отрицательным. Положительный заряд притягивает отрицательный как магнит образует ионное соединение хлорида лития (рис. 3).
Итак, мы рассмотрели такое свойство химического элемента, как сродство к электрону. Интересно, что это свойство атома напрямую связано с местоположением элемента в периодической системе химических элементов (рис. 4). При движении по диагонали этой таблицы от атома цезия к атому фтора, с левого нижнего угла к правому верхнему, сродство атома к электрону будет увеличиваться.

РАССМОТРИМ НЕСКОЛЬКО ПРИМЕРОВ:
При взаимодействии атомов натрия и хлора, атом натрия, теряющий электрон становится положительным (катионом), а атом хлора, забирающий электрон, становится отрицательным (анионом) (рис. 5)

Из рисунка 5 видно, что оба атома имеют приблизительно одинаковые радиусы, однако у атома хлора третья орбиталь практически заполнена. Поэтому энергетически намного выгоднее перенести одинокий валентный электрон натрия на атом хлора. Эта связь называется ионной и имеет электростатический характер взаимодействия, а разность электроотрицательностей атомов очень большая.
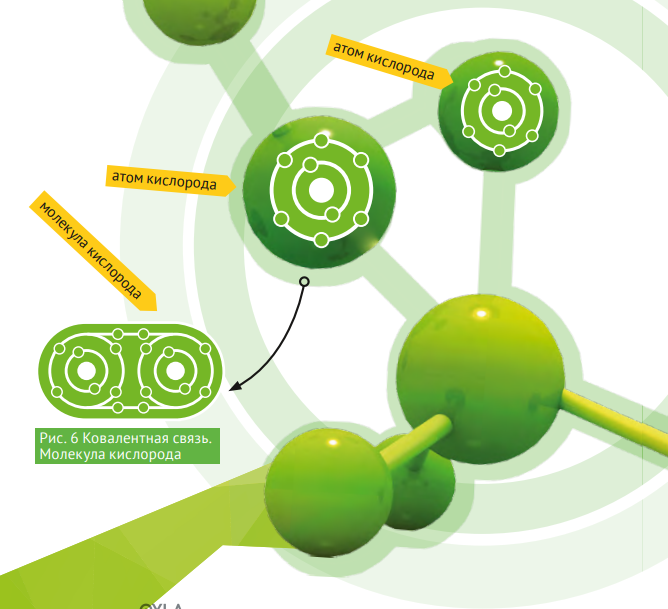
Рассмотрим молекулу, атомы которой имеют одинаковую электроотрицательность (сродство к электрону). Такое возможно только при взаимодействии атомов одного и того же элемента. Например, молекула кислорода О2 имеет дипольный момент равный нулю, т.е. разность электроотрицательностей равна нулю. В данном случае нет переноса электрона, а имеет место обобщение валентных электронов и перекрывание орбиталей (рис. 6). Данная связь называется ковалентной и она неполярна. Ковалентная связь образуется между атомами элементов, имеющих высокое сродство к электрону.
При взаимодействии атомов разных элементов с высоким сродством к электрону также образуется ковалентная связь, однако она будет полярной, так как разность электроотрицательностей не равна нулю. Примеры такого взаимодействия: H2O, CO2, PCl5 и так далее.
Периодическая система
Периодическая система (ПС) состоит из групп (семейств) элементов, которые расположены вертикальными линиями. Всего 8 групп: щелочные металлы, щелочноземельные металлы, земельные металлы, группа углерода, группа азота, халькогены, галогены и благородные газы.
Горизонтальные линии ПС называются периодами.
В пределах группы электроотрицательность увеличивается снизу вверх, а в пределах периода — слева направо.
Например, что произойдет с алюминием при длительном нахождении на воздухе?
Алюминий — элемент третьей группы, количество валентных электронов равно 3, значит, он может отдать эти 3 электрона атому другого элемента. В состав воздуха входит молекула кислорода, атом которого очень электроотрицателен. Элемент находится в шестой группе, значит количество валентных электронов равно 6. Не хватает 2 электронов для заполнения орбитали. Таким образом, 2 атома алюминия отдают по три электрона 3 атомам кислорода. Таким образом, мы получаем соединение оксид алюминия Al2O3, которым покрыты все алюминиевые изделия (столовые приборы, детали автомобиля, фольга, изделия красоты и т.д.).
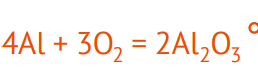
ПЕРИОДИЧНОСТЬ
Итак, мы узнали, что особенности взаимодействия конкретного элемента с другимиф элементами можно предсказать, зная лишь его расположение в периодической таблице. Вернемся ко второму рисунку (периодическая таблица), как вы видите, все элементы делятся на группы.
Элементы первой группы имеют один валентный электрон, который может быть перенесен на атом более электроотрицательного элемента.
Элементы второй группы — 2 валентных электрона, элементы третьей группы — 3 валентных электрона. У элементов с четвертой группы по седьмую, электроотрицательность высокая, а значит для них характерны ковалентные связи.
Периодическая система элементов — способ классификации химических элементов, устанавливающая связь между зарядом ядра (количеством протонов) и свойствами атома. Отцом периодического закона принято считать Д.И. Менделеева, который впервые ввел термин Например, что произойдет с алюминием при длительном нахождении на воздухе? «периодичность», а также сформулировал периодический закон соотношений атомных весов элементов. Он предсказал свойства некоторых неоткрытых элементов. Но особая заслуга Менделеева не в том, что он расположил элементы в определенном порядке, а в том, что представил эти закономерности как общий закон природы. Современная периодическая таблица отличается от Менделеевской тем, что номер атома привязан к заряду атома, а не к атомному весу.






