В предыдущем номере мы рассказывали о том, что такое химические элементы, и каковы их свойства. Как писать уравнения реакции вы уже знаете. А знаете ли вы, что абсолютно все химические процессы можно описать, используя тот же язык химии? На уроках химии мы часто пишем символы элементов и их комбинации. Многие дети спрашивают, для чего нужны эти уравнения с непонятными буквами и как они связаны с настоящей химией.
На самом деле, с помощью этих уравнений мы можем делать удивительные вещи: получать редкие вещества, проводить эксперименты, не прибегая к опытам, предсказывать, что получится при смешении различных соединений и даже «взрывать»! Положив кусочек натрия в воду, можно получить небольшой хлопок (маленький взрыв). Будьте осторожны! Даже немного влаги может «поджечь» натрий. Да, вода может поджечь! Есть два способа это проверить: провести эксперимент, что очень опасно, или описать процесс формулами:
Na + H 2 O = BOOM!
На самом деле в результате реакции получается основание NaOH и водород H 2 — легколетучий газ, а также выделяется огромное количество энергии Q. На языке химии это выглядит так:
2Na + 2H 2 O = 2NaOH + H 2 + Q
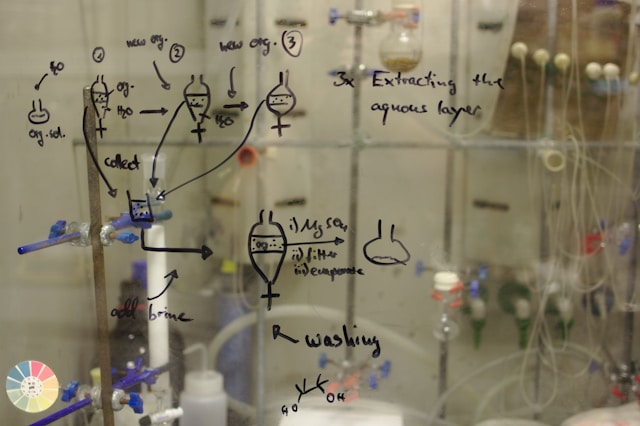
Взрывоопасный натрий и летучий хлор в класс химии не принесешь. Но из них можно получить вполне безобидную и даже полезную поваренную соль. С помощью уравнения химической реакции, в живую соединять эти вещества нам и не понадобится. Зная символы и правила, по которым строятся реакции, можно перенести этот и любой другой эксперимент прямо в тетрадь.
Сегодня я расскажу, как это сделать и каких правил нужно придерживаться. Но для начала хочу вам рассказать, почему эти реакции происходят и, вообще, что можно назвать химической реакцией.
Попробуйте провести опыт самостоятельно. Для этого оставьте молоко в открытой банке на несколько дней. Что, по-вашему, должно произойти? Вероятно, молоко испортится и начнет неприятно пахнуть. Это химическая реакция? А что если кефир медленно нагревать в закрытой кастрюле? Наверное, мы получим йогурт. Можно ли это назвать химическим процессом или реакцией? А заваривание чая? А таяние льда?
Все, что происходит вокруг нас каждый день, имеет химическое и физическое объяснение. Понимание этих процессов помогает нам справляться с возникающими трудностями.
Физика или химия
Вещества в природе стремятся к наиболее энергетически выгодному состоянию. Элементы или их соединения попросту не могут существовать в условиях энергетического напряжения. Например, вы не найдете ледяных глыб в странах Северной Африки. Почему? С одной стороны, кажется, что это странный вопрос, ведь лед должен растаять от жары. Но в чем истинная причина? Дело в том, что молекулы воды во льду находятся очень близко друг к другу, они жестко зафиксированы. При повышении температуры расстояние между ними увеличивается, так как тепловая энергия, превращаясь в кинетическую, «разгоняет» молекулы, заставляя их отдаляться. При этом лед сначала превращается в жидкость, то есть в воду, а затем в пар. И так везде. В природе все процессы нацелены на снижение возникающего напряжения.
(Молекулы в твердых веществах находятся очень близко друг к другу и практически не двигаются. В жидкостях расстояние увеличено, но молекулы все еще связаны, поэтому жидкости способны менять форму. Молекулы в газах практически не связаны друг с другом и перемещаются независимо. По этой причине объем газов можно менять) Процессы делятся на физические и химические. В физических состав веществ остается неизменным. В качестве примера можно привести тот же процесс таяния льда или испарения жидкой воды. Лед — это твердая вода, химический состав которой H 2 O, пар — это газообразная вода, химический состав тот же. Значит, когда мы выпариваем воду, то лишь меняем ее физическое состояние, а химически она (вода) не изменяется. Если вы разобьете стакан, то это тоже процесс физический. Потому как стакан — это большой красивый осколок стекла, имеющий форму с названием «стакан». Химический состав остается неизменным.
С химическими явлениями дела обстоят куда сложнее! В случае химических процессов вещества претерпевают необратимые изменения. Меняются состав веществ и их свойства. При этом физическое состояние может также меняться. В качестве примера рассмотрим процесс горения свечи.
При горении свечи органические составляющие (углеводороды) взаимодействуют с кислородом и превращаются в углекислый газ (CO 2 ) и воду (H 2 O). В этом случае наблюдается изменение состава. Данную химическую реакцию можно описать прямо в тетради. Нам даже не понадобится свеча.
Уравнение химической реакции
Возьмем самый простой углеводород — метан (основной компонент природного газа). Формула метана — CH 4 . Это – соединение двух элементов: углерода (символ С) и водорода (символ Н). А горение — это процесс окисления вещества кислородом — О2. Процесс горения на формуле будет выглядеть следующим образом
CH 4 + O 2 = ?
Как закончить это уравнение?
При совместном присутствии молекул кислорода и метана при высокой температуре возникает энергетическое напряжение, о котором мы говорили ранее. Вы уже знаете что, элементы пытаются снизить это напряжение. Молекулы, обмениваясь атомами, и превращаются в другие молекулы, существование которых в данных условиях выгоднее. При взаимодействии кислорода с метаном, элементы последнего связываются с атомами кислорода. Из предыдущего номера, вам уже известно, что кислород обладает большим сродством к электрону, и он способен отобрать электроны и у углерода, и у водорода. Атом кислорода связывает углерод и водород, и появляются соединения CO2 (углекислый газ), H 2 O (вода).
Теперь закончим уравнение:
CH 4 + O 2 = CO 2 + H 2 O
(По правилам написания уравнения химической реакции количества атомов слева и справа должны быть равны. Поэтому слева перед кислородом и справа перед водой ставим двойку).
CH 4 + 2O 2 = CO 2 + 2H 2 O
Итак, мы написали и уравняли химическую реакцию. По такому же алгоритму можно попробовать написать уравнение взаимодействия других соединений.
Химия в организме
Рассмотрим другой пример химической реакции. Например, усваивание углеводов, происходящее в нашем организме. Известно, что организм берет энергию из углеводов, точнее получает ее в результате их химической переработки. Обозначим все углеводы условно формулой глюкозы (С6Н12О6 ). Под воздействием ферментов в организме происходит разрушение глюкозы, и как результат выделяется энергия, необходимая для работы организма. Один из видов разрушения углеводов происходит при участии кислорода. Опишем процесс химическими формулами:
С 6 Н12 О 6 + О 2 = Атом кислорода связывает атомы углерода и водорода. Получаются снова углекислый газ и вода. (Все органические соединения содержащие атомы углерода, водорода и кислорода, окисляются с образованием углекислого газа и воды)
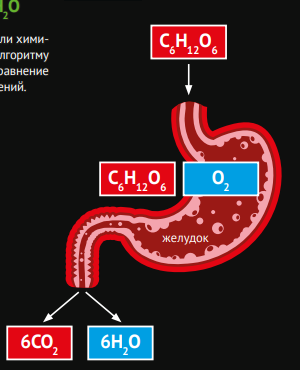
Итак, уравнение с правильными коэффициентами выглядит следующим образом:
С6 Н12О6 + 6О2 = 6СО2 + 6Н2 О
Таким образом, организм получает энергию из углеводов, например для занятий спортом. Вышеописанные процессы — это примеры взаимодействия органических соединений. Однако в повседневной жизни встречаются и реакции с участием неорганических веществ.
Вот пример:
Удалим накипь. Ваши мамы часто сталкиваются с проблемой накипи в электрических чайниках. Для его ее удаления обычно используют уксус. Так что же происходит с накипью при кипячении с уксусом?
Уксус — это разбавленный раствор уксусной кислоты (формула СН3 СООН), а накипь — это нерастворимая соль кальция (городская вода содержит в небольших количествах соли кальция) с формулой СаСО3 (карбонат кальция). При кипячении карбонат кальция превращается в растворимую соль. Таким образом, мамы залив чайник уксусным раствором и нагревая его, искусственно создают в чайнике напряжение, которое вещества участники пытаются снизить. Напишем уравнение «любимого» эксперимента ваших мам
Итак, уравнение: СаСО3 + СН3 СООН =
Запомните! Неогранические соединения взаимодействуют в следующих случаях:
1. При выделении нерастворимого вещества;
2. При выделении газообразного вещество;
3. При выделении теплоты. Данные состояния обладают минимальной энергией, поэтому возможность их образования выгодна. В данной реакции анионы и катионы меняются местами:
СаСО3 + 2СН3 СООН =
Са(СН3 СОО)2 + Н2 СО3 Н2 СО3
при кипячении распадается на воду (Н2 О) и углекислый газ (СО2 ). А полученная соль в воде очень хорошо растворяется. Растворение накипи в уксусе химически возможно.
ПРАВИЛА НАПИСАНИЯ УРАВНЕНИЯ РЕАКЦИИ
- Итак, для описания химического взаимодействия уравнением реакции необходимо:
- Написать химическую формулу вещества в соответствии с правилами, описанными в статье про элементы (см. Статью «Такие разные элементы»);
- Оценить возможность их взаимодействия;
- Написать формулу предполагаемого продукта;
- Уравнять реакцию (количества атомов слева и справа)
Не забывайте! Вещества не хотят напрягаться!
Углерод находится в 4-группе периодической системы химических элементов (ПСХЭ), а значит имеет 4 валентных электрона на внешнем энергетическом уровне (см. Статью «Такие разные элементы»), а у водорода 1 валентный электрон (он находится в первой группе ПСХЭ). Таким образом, 4 одиночных электрона углерода связываются с электронами четырех атомов водорода с образованием ковалентной связи (см. статью «Химические связи»). В результате мы получаем формулу метана СН4