Чем ярче — тем теплее? Жизненный опыт подсказывает нам, что эти два понятия неразделимы. Но законы химии опровергают такую зависимость: свечение вещества может быть «холодным», совсем не связанным с нагревом. А самое удивительное — подобные явления встречаются буквально на каждом шагу.
Светящиеся термины Для освещения комнаты достаточно включить лампочку, а если вы находитесь в лесу, придётся развести костёр. Чем больше огня, тем больше света. Кроме того, рядом с костром можно согреться, если ночь холодная. А утром появится естественное светило, разогретое до 6000 К Солнце, и станет всем тепло и светло. Такой вид излучения называется тепловым. На самом деле способностью к нему обладают абсолютно все физические тела, если их температура выше 0 К. Например, приборы ночного видения регистрируют невидимое человеческому глазу тепловое излучение живых существ. Чтобы излучение стало видимым, необходимо разогреть тело до 1000 К. Свечение же без излучения тепла называется люминесценцией (от лат. luminous — свет и escent — слабое воздействие). Люминесцирующие вещества преобразуют энергию в оптическое излучение. Накачанные энергией атомы возбуждаются и испускают кванты света (фотоны), чтобы вернуться в прежнее состояние. Причём без энергетических потерь не обходится: фотон, возбуждающий атом, должен иметь большую энергию, чем люминесцентный. То есть чтобы вызвать люминесценцию, нужно затратить больше энергии, чем получится в итоге, — этот невесёлый факт называется стоксовскими потерями.
Первыми опробовали свечение без тепла люминофоры — вещества, в названии которых к упомянутому латинскому lumen добавилось греческое phoros — несущий. «Носители света» разнообразны: оксиды, сульфиды, фосфаты и силикаты со специальными активирующими добавками в виде сурьмы, олова, марганца и других тяжёлых металлов. Заставить люминофоры светиться несложно — надо лишь облучить их ультрафиолетовым светом. И мы наблюдаем это практически ежедневно в тёмное время суток. Лампы дневного света, в которых пары ртути под действием электрического разряда излучают УФ-лучи, покрыты изнутри комплекными солями состава Ca10(PO4 ) 6 FCl или Sr10(PO4 ) 6 FCl с добавками олова и марганца — типичными люминофорами. Главными преимуществами таких светильников являются рассеянный и более комфортный свет, большая светоотдача и значительный срок службы.
Исследуя «холодное» свечение, учёные открыли два новых явления: флуоресценцию и фосфоресценцию. Если после поглощения энергии люминофор светится короткое время, около 10–8–10– 9 секунд, его называют флуоресцирующим. Впервые это излучение зафиксировали при облучении редкого кристалла флюорита (фторид кальция CaF2 ) УФ-лучами — отсюда и название. Сегодня дневные флуо ресцирующие красители используются при изготовлении деталей одежды, афиш и вывесок, маркеров, делающих нашу жизнь ярче и веселее.
А вот когда люминесценция не прекращается вместе с действием источника возбуждения, мы говорим о фосфоресценции (от греч. phos — свет и phoros — несущий). Покрытие циферблатов часов, стрелок и шкал приборов, люминофоры в лампах дневного света, краски для ёлочных игрушек — всё это области применения фосфоресценции в современном мире.
ХИМИЯ ЭЛТ
Люминофоры использовались в дисплеях телевизоров и мониторов с электронно-лучевой трубкой (кинескопом). Внутреннее покрытие таких дисплеев из сульфида цинка ZnS с серебром излучает синий свет, смешанный сульфид цинка и кадмия (Zn, Cd)S с медью и алюминием отвечает за зелёный, а экзотический оксид — сульфид иттрия Y2 S3 , активированный европием, — обеспечивает красный. «Телевизионные» люминофоры, начинавшие светиться от пучка электронов, получили отдельное название — катодолюминофоры.
Кристаллы флюорита способны к свечению при нагревании — термолюминесценции. Флюорит является типичным флуоресцирующим минералом, однако при нагревании и после облучения ультрафиолетовым светом он фосфоресцирует.
СВЕЧЕНИЕ ЛЮМИНОЛА
Наследие Хеннига Бранда
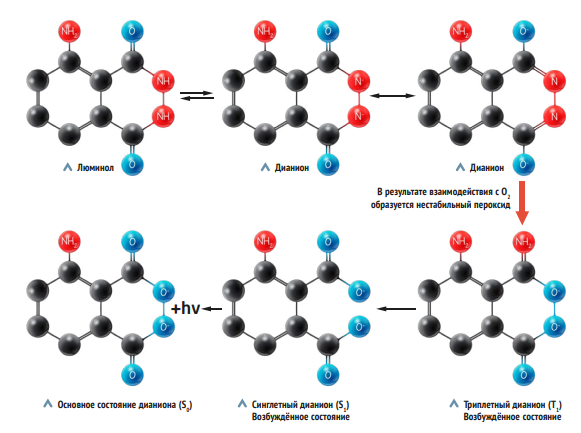
Гамбург, 1669 год. Алхимик Хенниг Бранд совершенно случайно открывает белый фосфор. Яркий свет, озаривший его лабораторию, не был проявлением фосфоресценции, так как фосфор светил продолжительное время без внешнего воздействия. Источником энергии стала реакция испаряющегося фосфора с кислородом воздуха, которая и питала свечение вещества, — спустя столетия это явление назовут хемилюминесценция. Выделяемая в ходе реакции энергия переходит в световую и чаще всего едва видна даже в полной темноте. Но есть исключения, заметные даже при дневном свете, как, к примеру, окисление люминола перекисью водорода.
Способность к интенсивному синему свечению — следствие превращения люминола в щелочной среде в дианион с последующим окислением кислородом до нестабильного радикала, который, распадаясь, излучает фотоны.
Хемилюминесцентные свойства люминола используются в криминалистике для обнаружения следов крови. Оказывается, железо, входящее в состав гемоглобина, является отличным катализатором окисления люминола, что позволяет с высокой чувствительностью (1 часть на 1 000 000) определять кровь на месте преступления. И всё бы хорошо, но такое же воздействие оказывают ионы меди, входящие в состав белка гемоцианина, а это уже составная часть крови осьминогов, пауков и других холоднокровных. Применять столь чуткое соединение в качестве источника света очень недёшево, поэтому химики синтезировали дифениловый эфир щавелевой кислоты С6 Н5 О-СО-СО-ОС6 Н5 — недорогой аналог люминола, использующийся в «светящихся палочках».
Внутри такой игрушки находится запаянная стеклянная колба с 0,5%-ным раствором перекиси водорода, окружённая фенилоксалатом. Стоит переломить «светящуюся палочку», и запустится реакция образования С6 Н5 О-СО-СО-ООН — соединения, которое впоследствии распадается, излучая кванты света. А они в свою очередь инициируют флуоресценцию добавленных красителей: рубилена (оранжевый цвет), перилена (голубой), тетрацена (зелёный), дифенилантрацена (сине-фиолетовый) и самого распространённого — бис( фенилэтинил)антрацена (яркий жёлто-зелёный).
Светящиеся моря Биолюминесценция, или свечение биологических объектов, при всей своей экзотичности достаточно распространена в природе. Так, в американской светящейся мушке идентифицирован и выделен пигмент люциферин, разновидности которого встречаются в светлячках, мелких ракообразных, глубоководных рыбах и моллюсках. Окисление люциферина в составе простейших микроорганизмов отвечает за самое, наверное, захватывающее зрелище в природе — свечение ночного океана.
Какие только идеи не выдвигались для объяснения свечения морской воды! От божественного провидения до особых свойств морской соли. И только в начале XIX века российский мореплаватель, адмирал Иван Крузенштерн предположил, что причина в обитающих в воде крохотных организмах. И действительно, спустя некоторое время было доказано, что световое шоу в периоды особенного морского волнения устраивают одноклеточные динофлагелляты. Механическое воздействие воды на микроорганизмы вызывает электрические импульсы, которые поступают в особые мембранные пузырьки сцинтиллоны, содержащие люциферин. Внутренняя среда в пузырьках за счёт открытия ионных каналов закисляется, и динофлагеллят расцветает холодным голубым «пламенем». Но такая красота опасна: чрезмерная активность микроорганизмов отравляет воду токсинами и снижает содержание кислорода, что часто приводит к гибели морских обитателей.
НОБЕЛЕВСКАЯ МЕДУЗА
Медуза Aequorea victoria в моменты раздражения светится зелёным — этот феномен взял на заметку в 1960 году японский биолог Осаму Симомура. Совместно с исследователями из Принстонского университета Симомура выделил из медузы люминесцентный белок экворин, однако в лабораторных условиях он светился синим, а не зелёным. Оказалось, что у медузы есть ещё один «цветной» белок — тот самый нобелевский Green Fluorescent Protein. Зелёное свечение этого белка инициируется синим светом экворина.
К концу 1970-х годов о природе GFP было известно фактически всё, и учёные задумались о его практическом применении. Профессор Колумбийского университета Мартин Чалфи занялся внедрением гена GFP в геном организмов. Начал с классической E. coli, а затем ввёл ген флуоресцентного белка в наследственный аппарат нематоды C. elegans и смог отследить все этапы развития нейронов червя. С тех пор GFP-маркеры, светящиеся в УФ-излучении, стали незаменимыми помощниками в исследованиях синтеза белка и других внутриклеточных процессов.
Наконец, Роджер Тсиен, профессор Калифорнийского университета Сан-Диего, к 1996 году раскрыл последние нюансы работы флуоресцентного белка и модифицировал его, создав варианты, светящиеся голубым, жёлтым и сине-зелёным цветом.
Экзотические люминофоры
Fluorescent proteins — флуоресцентные светящиеся белки, способные к достаточно интенсивной люминесценции в видимом диапазоне. Белок Green Fluorescent Protein (GFP), выделенный из медузы, способен светиться зелёным при облучении синим, а его мутантная форма люминесцирует жёлтым светом.
Подобные белки используются как флуоресцентные метки в клеточной и молекулярной биологии для изучения биосинтеза белков. Учёные встраивают гены, кодирующие GFP-белки, в наследственный аппарат животных, и те начинают светиться зелёным. Исследования биологической люминесценции были отмечены в 2008 году Нобелевской премией по химии — её присудили Осаму Симомуре, Мартину Чалфи и Рождеру Тсиену. Стоит упомянуть про электролюминофоры, которые мы видим каждый день — иногда по несколько раз.
Эти соединения светятся под действием электрического поля, потребляют мизерное количество энергии и в принципе неспособны перегореть, как это происходит с лампами накаливания. Надпись «ВЫХОД» в школах, киноконцертных залах и других местах массового скопления людей зачастую изготавливают из таких люминофоров. Радиолюминофоры — вещества, излучающие свет под влиянием естественной или искусственной радиации. В первой половине ХХ века учёные покрывали внутреннюю поверхность стеклянных экранов дорогими платинатами бария, чтобы по жёлто-зелёной люминесценции отслеживать интенсивность излучения радиоактивных веществ; таможенники просвечивали так багаж пассажиров. Позднее соединения платины заменили дешёвым сульфидом цинка и додумались смешивать его с микроскопическими количествами радиоактивных металлов. Этим опасным составом окрашивали циферблаты часов, наделяя их способностью светиться почти вечно.
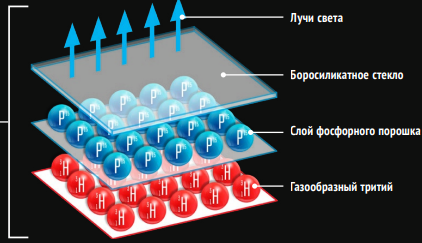
К счастью, эта инновация канула в Лету, но радиолюминесценция не ушла из часового бизнеса — современные наручные аксессуары всё больше используют подсветку на основе трития, точнее, тритий-газового светового источника, или тригалайта. Этот сверхтяжёлый водород в газообразном состоянии заключён в миниатюрную колбу из боросиликатного стекла, изнутри покрытого тонким слоем радиолюминофора. Бета-распад трития вызывает поток электронов, энергии которых не хватает для прохождения сквозь стекло, но вполне достаточно для инициации свечения люминофора. Самое замечательное в таких часах — срок непрерывного свечения, превышающий 20 лет.
«Холодное» свечение встречается буквально на каждом шагу. Банковские купюры, защищённые люминофорами от подделок, минералы, животные, растения, газы, жидкости постоянно излучают люминесцентное свечение. Остаётся обзавестись ультрафиолетовым зрением, чтобы оценить всю эту красоту.
БЕТА-РАСПАД ТРИТИЯ
Радиоактивный тритий заключён в герметичную ёмкость из боросиликатного стекла, на внутреннюю поверхность которой нанесён слой люминофора. Электроны, испускаемые в результате бета-распада трития, возбуждают атомы люминофора, которые затем переходят из возбуждённого состояния в обычное и испускают фотоны. Ввиду малой энергии электронов толщины люминофора и стенок ёмкости достаточно, чтобы полностью поглотить электроны.
Сленговое выражение «Мне это фиолетово», означающее безразличие, своим появлением обязано цвету индикатора лакмуса, который в нейтральной среде принимает фиолетовую окраску. Впрочем, индикаторы применяются не только в химии – есть индикаторы радиоактивного излучения, электрического тока, состояния окружающей среды.
Что такое индикатор
В химии индикатор – это соединение, которое даёт окрашенные продукты в результате взаимодействия с определёнными веществами. Цвет продукта и интенсивность окраски зависят от содержания определяемого компонента в смеси. Благодаря изменению окраски индикатора можно быстро провести анализ. Существуют индикаторы металлов, кислотности, влажности, диагностики заболеваний и многие другие.
Кислотно-основный индикатор меняет цвет в зависимости от кислотности или основности среды. Он представляет собой органическое амфотерное соединение, способное реагировать и с кислотами, и с основаниями. Механика его работы такова: ионы Н+ в кислом растворе протонируют молекулу индикатора, заряжая её положительно, а ионы ОН– в щелочном растворе отрывают протоны от кислотных групп индикатора, формируя на молекуле отрицательный заряд. Количество положительных или отрицательных зарядов на молекуле индикатора в конечном счёте и приводит к изменению её окраски.