Словосочетание «периодический закон» в научном мире впервые прозвучало 6 марта 1869 на заседании Русского химического общества. Потребовались десятилетия, прежде чем идея периодов в химии получила заслуженное признание, а в последующем и статус одного из фундаментальных законов мироздания. Автором закона был русский учёный Дмитрий Иванович Менделеев.
Графическим отображением Закона стала Периодическая система (таблица Менделеева). В честь 150-летнего юбилея Периодического закона ООН провозгласила 2019 год Международным годом Периодической таблицы химических элементов.
СОН В ЛЕТНЮЮ НОЧЬ
Периодический закон Д М — одно из наиболее важных научных достижений, отражающее фундаментальные основы химии, а история его признания и развития похожа на детективный роман, окружённый множеством легенд. Самая главная из них — будто бы окончательный вариант таблицы приснился учёному во сне. Правдиво в этой истории только то, что Менделеев долго и кропотливо работал над этой идеей. Это подтверждают его друзья и многочисленные письма. Сам Менделеев и его коллеги никогда не упоминали о «чудесном сновидении». А на вопрос репортёра «Петербургского листка» о том, как родилась мысль о периодической системе, учёный ответил:
«…Не пятак за строчку! Не так, как вы! Я над ней, может, двадцать пять лет думал, а вы полагаете: сидел, и вдруг пятак за строчку, пятак за строчку, и готово!..»
ЗАКОНЫ РАЗНЫЕ
Современная периодическая таблица заканчивается самым тяжёлым на сегодня химическим элементом оганесон с порядковым номером 118. А в середине ХIX века химикам было известно всего 63 элемента. Как их записывать? В алфавитном порядке? Или по мере их открытия? Связывает ли их какая-то закономерность или её вовсе нет? Ведь речь шла об кирпичиках, из которых сделана наша Вселенная! Все эти вопросы требовали ответа, а человек — очень любопытное создание, так уж он устроен. Поэтому первые открытия не заставили себя долго ждать. Попыток было множество, но мы коснёмся только двух ключевых.
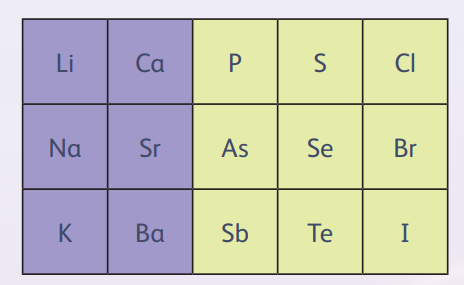
Немецкий химик И В Д в 1829 году заметил, что некоторые сходные по своим свойствам элементы можно объединить в группы по трое, да так, чтобы атомная масса среднего элемента этой тройки была близка к среднему арифметическому атомных масс соседних. Эта была первая серьёзная попытка упорядочить химические элементы. Триады Дёберейнера доказывали, что существует взаимосвязь между атомной массой и свойствами элементов, причём первая, скорее всего, была определяющей. Увы, триады охватывали только 15 элементов, остальные в правило не уложились. Так что эта идея не могла претендовать на всеобщую закономерность.
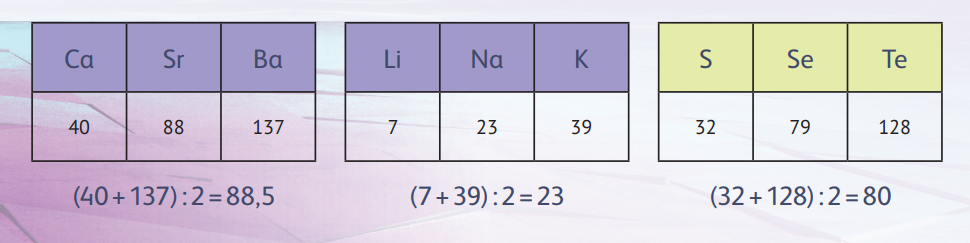
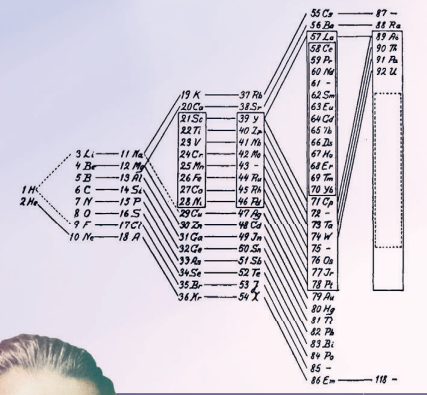
В 1864 году английский учёный Д Н расположил элементы в порядке возрастания их атомных масс и обнаружил сходство в свойствах между каждым восьмым элементом, что было похоже на повтор семи нот в музыкальных гаммах, благодаря чему они получили название октавы Ньюлендса. Затем химик пронумеровал элементы и собрал их в столбцы по семь штук.
Обратите внимание на начало второй строчки таблицы Ньюлендса — Li, Na, K. Это хорошо знакомая нам триада Дёберейнера, а внимательный читатель найдёт и другие. Ньюлендс впервые высказал идею о том, что свойства элементов повторяются с определённой периодичностью.
Неужели Пифагор, убеждённый, что музыка есть производная от божественной науки математики, и в ней проявляется вселенская гармония, был прав? Идея октав была невероятно красивой, поэтому Ньюлендс не смог от неё отказаться. К сожалению, это привело к тому, что не все строки таблицы сохраняли идентичные свойства, поэтому идея английского химика была воспринята сообществом как красивое, но всё же случайное совпадение.
ЗАКОН МЕНДЕЛЕЕВА
В середине XIX века идея о стройной системе химических элементов так и витала в воздухе. Долгие поиски и размышления привели Дмитрия Менделеева к пониманию, что за основу систематики следует взять атомную массу элемента. По словам самого учёного, он использовал 63 отдельных карточки, на которых были записаны известные к тому времени элементы. Так началась игра в химический пасьянс. Во-первых, он разместил элементы со схожими свойствами в ряды. Во-вторых, отсортировал элементы в порядке увеличения их атомных масс. Далее необходимо было проверить каждую комбинацию и исключить противоречия. Это был долгий процесс, но в конце концов родилась долгожданная система. Однако периодической таблице Менделеева предстояло претерпеть ещё множество изменений, прежде чем она приобрела привычный нам вид.

КАК РАБОТАЕТ ТАБЛИЦА?
Первоначально Менделеев сформулировал Перио дический закон так: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса». О каких же свойствах идёт речь? Прежде всего о тех, что важны при объяснении или предсказании химических реакций: электроотрицательности, степени окисления, энергии ионизации атомов.
Одна из главных догадок Менделеева состояла в предположении, что он имеет дело с неполным списком элементов. Чтобы элементы со схожими свойствами могли стоять ровно в ряд, Менделеев вставлял пустые карточки. Например, обратите внимание на знак вопроса напротив 68-й атомной массы. Менделеев полагал, что на этом месте должен быть ещё не известный нам элемент, который он называл экаалюминий. Его ожидания подтвердились: в 1875 году был открыт галлий с атомной массой 69,9. Также при жизни Менделеева были также открыты скандий и германий, существование которых он предсказывал.
Периодический закон Дмитрия Менделеева: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».

ЕЩЁ БОЛЬШЕ ОТКРЫТИЙ
Современники Менделеева не имели представления о том, как на самом деле выглядит атом. Только в 1911 году Э Р доказал, что в атоме есть положительно заряженное ядро и электроны. Позже его коллега Г М, проведя серию экспериментов, установил линейную взаимосвязь между количеством протонов в атомном ядре и частотой колебаний рентгеновских лучей, испускаемых химическими элементами. В 1914 году Мозли представил таблицу атомных номеров (количество протонов), которая в точности совпала с таблицей Менделеева, но была точнее. На основе своей таблицы Мозли предсказал существование новых элементов, которые вскоре и были открыты: гафний (№ 72) и рений (№ 75).
Так в периодический закон была внесена существенная поправка: вместо атомной массы (совокупная масса нуклонов) было предложено использовать атомное число (количество протонов в ядре).
В 1912 году выдающийся датский физик-теоретик Н Б, будущий отец квантовой физики, переезжает в Манчестер к Эрнесту Резерфорду, который только-только представил миру планетарную модель атома. Взяв её за основу, Бор предлагает свою модель устройства атома, в которой описывает взаимодействие электронов. Согласно его модели, электроны могут находиться только на определённых орбитах, для перехода между которыми требуется энергия. Электроны на дальних орбитах наименее прочно связаны с ядром и могут отрываться от него, что меняет общий заряд атома. Тем самым, Нильс Бор приходит к выводу, что расположение электронов определяет химические свойства элемента.
В 1922 году Нильс Бор создаёт свою периодическую таблицу на основе экспериментальных измерений энергий электронов, иначе говоря, предопределяя их химические свойства. Она тоже соответствовала таблице Менделеева.
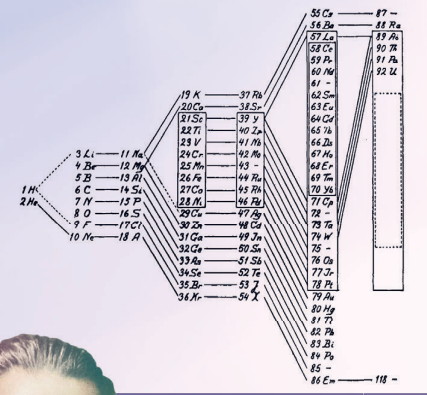
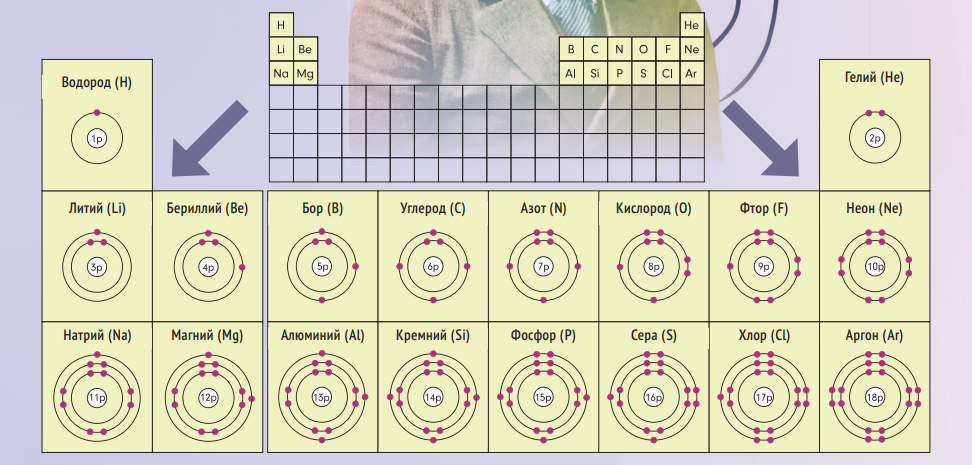
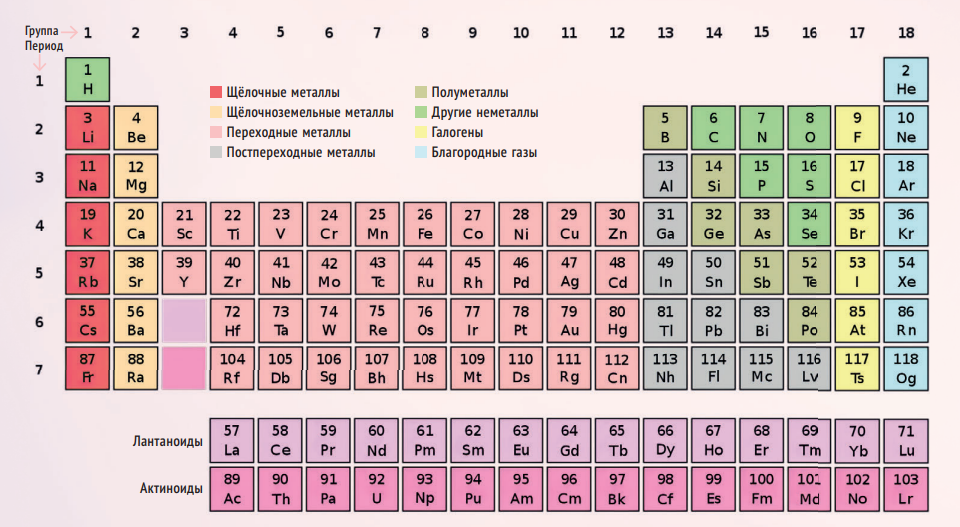
ФИНАЛЬНЫЙ ВАРИАНТ
Периодическая таблица — это всего лишь представление периодического закона: его различных графических схем существует бесчисленное множество. Но если попросить вас закрыть глаза и представить какую-нибудь одну, вы, скорее всего, увидите «классическую» версию, которая была представлена американским химиком Г С.
Сиборг — это человек, который, прежде всего, дополнил таблицу Менделеева новой строчкой. Что неудивительно, ведь он был причастен к открытию десяти новых элементов: плутония, америция, кюрия, берклия, калифорния, эйнштейния, фермия, нобелия и ещё двух, на которых мы остановимся чуть подробнее. В 1955 году Сиборг с коллегами открыли 101-й элемент, который назвали в честь Дмитрия Менделеева, — менделевий. В 1997 году в честь Сиборга назвали 106-й элемент — сиборгий. Как любил шутить химик, он единственный в мире человек, чей рабочий адрес можно записать, используя элементы периодической таблицы: Am, Cf, Bk, Lr, Sg — америций, калифорний, берклий, лоуренсий (лаборатория имени Лоуренса), сиборгий. Кстати, первые три он синтезировал лично!
Периодическая таблица элементов — это олицетворение величия человеческого ума. За каждой клеточкой которой скрывается победа над неизвестностью, а порядок их расположения отражает наше представление о Вселенной! Дмитрий Менделеев был одним из тех, кто задал верное направление в этом поиске.
Словосочетание «периодический закон» в научном мире впервые прозвучало 6 марта 1869 на заседании Русского химического общества. Потребовались десятилетия, прежде чем идея периодов в химии получила заслуженное признание, а в последующем и статус одного из фундаментальных законов мироздания. Автором закона был русский учёный Дмитрий Иванович Менделеев.
Графическим отображением Закона стала Периодическая система (таблица Менделеева). В честь 150-летнего юбилея Периодического закона ООН провозгласила 2019 год Международным годом Периодической таблицы химических элементов.
СОН В ЛЕТНЮЮ НОЧЬ
Периодический закон Д М — одно из наиболее важных научных достижений, отражающее фундаментальные основы химии, а история его признания и развития похожа на детективный роман, окружённый множеством легенд. Самая главная из них — будто бы окончательный вариант таблицы приснился учёному во сне. Правдиво в этой истории только то, что Менделеев долго и кропотливо работал над этой идеей. Это подтверждают его друзья и многочисленные письма. Сам Менделеев и его коллеги никогда не упоминали о «чудесном сновидении». А на вопрос репортёра «Петербургского листка» о том, как родилась мысль о периодической системе, учёный ответил:
«…Не пятак за строчку! Не так, как вы! Я над ней, может, двадцать пять лет думал, а вы полагаете: сидел, и вдруг пятак за строчку, пятак за строчку, и готово!..»
ЗАКОНЫ РАЗНЫЕ
Современная периодическая таблица заканчивается самым тяжёлым на сегодня химическим элементом оганесон с порядковым номером 118. А в середине ХIX века химикам было известно всего 63 элемента. Как их записывать? В алфавитном порядке? Или по мере их открытия? Связывает ли их какая-то закономерность или её вовсе нет? Ведь речь шла об кирпичиках, из которых сделана наша Вселенная! Все эти вопросы требовали ответа, а человек — очень любопытное создание, так уж он устроен. Поэтому первые открытия не заставили себя долго ждать. Попыток было множество, но мы коснёмся только двух ключевых.
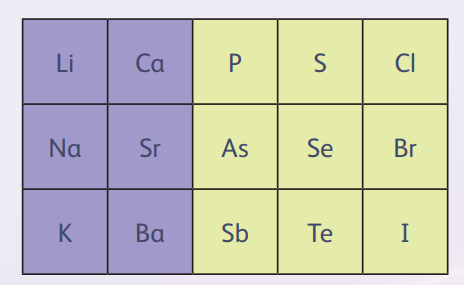
Немецкий химик И В Д в 1829 году заметил, что некоторые сходные по своим свойствам элементы можно объединить в группы по трое, да так, чтобы атомная масса среднего элемента этой тройки была близка к среднему арифметическому атомных масс соседних. Эта была первая серьёзная попытка упорядочить химические элементы. Триады Дёберейнера доказывали, что существует взаимосвязь между атомной массой и свойствами элементов, причём первая, скорее всего, была определяющей. Увы, триады охватывали только 15 элементов, остальные в правило не уложились. Так что эта идея не могла претендовать на всеобщую закономерность.
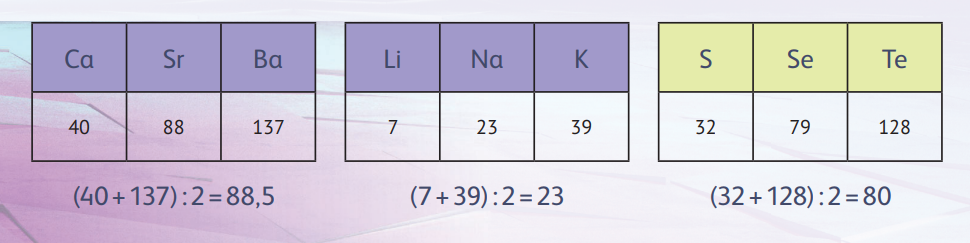
В 1864 году английский учёный Д Н расположил элементы в порядке возрастания их атомных масс и обнаружил сходство в свойствах между каждым восьмым элементом, что было похоже на повтор семи нот в музыкальных гаммах, благодаря чему они получили название октавы Ньюлендса. Затем химик пронумеровал элементы и собрал их в столбцы по семь штук.
Обратите внимание на начало второй строчки таблицы Ньюлендса — Li, Na, K. Это хорошо знакомая нам триада Дёберейнера, а внимательный читатель найдёт и другие. Ньюлендс впервые высказал идею о том, что свойства элементов повторяются с определённой периодичностью.
Неужели Пифагор, убеждённый, что музыка есть производная от божественной науки математики, и в ней проявляется вселенская гармония, был прав? Идея октав была невероятно красивой, поэтому Ньюлендс не смог от неё отказаться. К сожалению, это привело к тому, что не все строки таблицы сохраняли идентичные свойства, поэтому идея английского химика была воспринята сообществом как красивое, но всё же случайное совпадение.
ЗАКОН МЕНДЕЛЕЕВА
В середине XIX века идея о стройной системе химических элементов так и витала в воздухе. Долгие поиски и размышления привели Дмитрия Менделеева к пониманию, что за основу систематики следует взять атомную массу элемента. По словам самого учёного, он использовал 63 отдельных карточки, на которых были записаны известные к тому времени элементы. Так началась игра в химический пасьянс. Во-первых, он разместил элементы со схожими свойствами в ряды. Во-вторых, отсортировал элементы в порядке увеличения их атомных масс. Далее необходимо было проверить каждую комбинацию и исключить противоречия. Это был долгий процесс, но в конце концов родилась долгожданная система. Однако периодической таблице Менделеева предстояло претерпеть ещё множество изменений, прежде чем она приобрела привычный нам вид.

КАК РАБОТАЕТ ТАБЛИЦА?
Первоначально Менделеев сформулировал Перио дический закон так: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса». О каких же свойствах идёт речь? Прежде всего о тех, что важны при объяснении или предсказании химических реакций: электроотрицательности, степени окисления, энергии ионизации атомов.
Одна из главных догадок Менделеева состояла в предположении, что он имеет дело с неполным списком элементов. Чтобы элементы со схожими свойствами могли стоять ровно в ряд, Менделеев вставлял пустые карточки. Например, обратите внимание на знак вопроса напротив 68-й атомной массы. Менделеев полагал, что на этом месте должен быть ещё не известный нам элемент, который он называл экаалюминий. Его ожидания подтвердились: в 1875 году был открыт галлий с атомной массой 69,9. Также при жизни Менделеева были также открыты скандий и германий, существование которых он предсказывал.
Периодический закон Дмитрия Менделеева: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».

ЕЩЁ БОЛЬШЕ ОТКРЫТИЙ
Современники Менделеева не имели представления о том, как на самом деле выглядит атом. Только в 1911 году Э Р доказал, что в атоме есть положительно заряженное ядро и электроны. Позже его коллега Г М, проведя серию экспериментов, установил линейную взаимосвязь между количеством протонов в атомном ядре и частотой колебаний рентгеновских лучей, испускаемых химическими элементами. В 1914 году Мозли представил таблицу атомных номеров (количество протонов), которая в точности совпала с таблицей Менделеева, но была точнее. На основе своей таблицы Мозли предсказал существование новых элементов, которые вскоре и были открыты: гафний (№ 72) и рений (№ 75).
Так в периодический закон была внесена существенная поправка: вместо атомной массы (совокупная масса нуклонов) было предложено использовать атомное число (количество протонов в ядре).
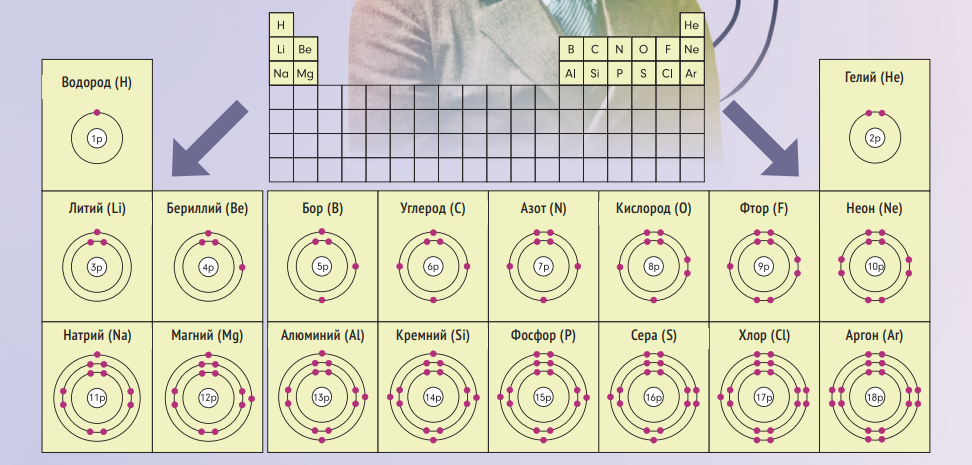
В 1912 году выдающийся датский физик-теоретик Н Б, будущий отец квантовой физики, переезжает в Манчестер к Эрнесту Резерфорду, который только-только представил миру планетарную модель атома. Взяв её за основу, Бор предлагает свою модель устройства атома, в которой описывает взаимодействие электронов. Согласно его модели, электроны могут находиться только на определённых орбитах, для перехода между которыми требуется энергия. Электроны на дальних орбитах наименее прочно связаны с ядром и могут отрываться от него, что меняет общий заряд атома. Тем самым, Нильс Бор приходит к выводу, что расположение электронов определяет химические свойства элемента.
В 1922 году Нильс Бор создаёт свою периодическую таблицу на основе экспериментальных измерений энергий электронов, иначе говоря, предопределяя их химические свойства. Она тоже соответствовала таблице Менделеева.
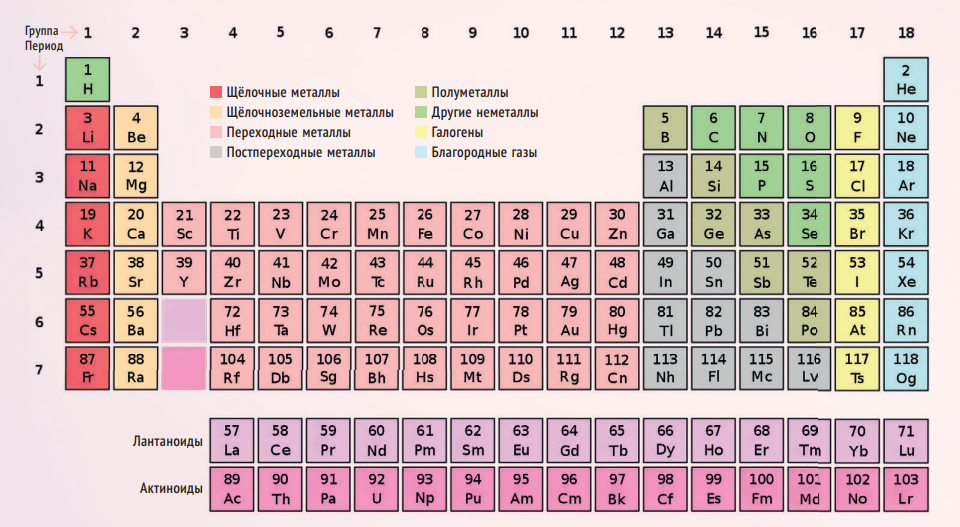
ФИНАЛЬНЫЙ ВАРИАНТ
Периодическая таблица — это всего лишь представление периодического закона: его различных графических схем существует бесчисленное множество. Но если попросить вас закрыть глаза и представить какую-нибудь одну, вы, скорее всего, увидите «классическую» версию, которая была представлена американским химиком Г С.
Сиборг — это человек, который, прежде всего, дополнил таблицу Менделеева новой строчкой. Что неудивительно, ведь он был причастен к открытию десяти новых элементов: плутония, америция, кюрия, берклия, калифорния, эйнштейния, фермия, нобелия и ещё двух, на которых мы остановимся чуть подробнее. В 1955 году Сиборг с коллегами открыли 101-й элемент, который назвали в честь Дмитрия Менделеева, — менделевий. В 1997 году в честь Сиборга назвали 106-й элемент — сиборгий. Как любил шутить химик, он единственный в мире человек, чей рабочий адрес можно записать, используя элементы периодической таблицы: Am, Cf, Bk, Lr, Sg — америций, калифорний, берклий, лоуренсий (лаборатория имени Лоуренса), сиборгий. Кстати, первые три он синтезировал лично!
Периодическая таблица элементов — это олицетворение величия человеческого ума. За каждой клеточкой которой скрывается победа над неизвестностью, а порядок их расположения отражает наше представление о Вселенной! Дмитрий Менделеев был одним из тех, кто задал верное направление в этом поиске.






