Тебе скучно на уроках химии? Не унывай! Мы подготовили рецепты захватывающих и в чём-то даже опасных опытов, которые можно осуществить в любой химической лаборатории. Для их реализации нужен опытный педагог, минимальный набор химических реактивов, строгое соблюдение техники безопасности и, конечно, чуточка отваги.
ШУМ, ДЫМ ОГОНЬ
На данный момент все сходятся во мнении, что это вещество было впервые получено в древнем Китае и использовали его для отпугивания злых духов. Сейчас мы знаем его как чёрный или дымный порох. В оружейной промышленности он почти не используется, но его можно отлично применять на уроках химии или занятиях профильного кружка.
Чтобы приступить к делу, подготовь набор. Понадобятся ступка с пестиком, железная или керамическая тонкостенная чаша, лучина, спички, калиевая селитра или нитрат калия (KNO3), порошкообразная сера (S) и активированный уголь (C).
И не забудь запастись весами с точностью до 0,1 грамм. Итак, взвесь исходные ингредиенты: • 7,5 грамм нитрата калия • 1 грамм серы • 1,5 грамма угля
Всё это тщательно перетри в ступке до порошкообразного состояния. Помни, чем мельче будет помол, тем зрелищнее будет демонстрация. Теперь щепотку полученного пороха высыпь в керамическую или металлическую посуду и подожги лучиной (не спичками!). Смесь замечательно воспламеняется, образуя облако густого дыма. Общий принцип реакции описывается сложным уравнением:

Как видно, три исходных вещества в доли секунды превращаются сразу в семь, причём четыре из них – газы. В этом и есть истинная взрывная сущность пороха – мгновенно расшириться в объёме в тысячу раз. Эта энергия столетиями заставляла вылетать снаряды и пули из стволов, дробила горную породу и меняла русла рек. В ходе войн «чёрный» порох, как ни одно другое вещество, перекраивал карту мира.
Парадоксальным на первый взгляд кажется опыт, в котором вспыхивает огонь… от капли воды. Эта увлекательная демонстрация возможна при наличии пипетки, сухой ступки с пестиком, фарфоровой или жестяной чаши, аммиачной селитры (NH4NO3), хлорида натрия (NaCl) или хлорида аммония (NH4Cl), порошка цинка (Zn) и воды. Позаботься, чтобы все реактивы и оборудование были абсолтно сухими, так как малейшая сырость может всё испортить. В фарфоровую ступку помести: • 4 грамма нитрата аммония (NH4NO3) • 1 грамм поваренной соли (NaCl) • 10 грамм порошкообразного цинка Если для пущего эффекта нужно очень много дыма, то поваренную соль можешь заменить на хлорид аммония. После тщательного перетирания щепотку (не больше!) смеси помести в фарфоровую или жестяную чашу и из пипетки добавь 2-3 капли воды. Пара секунд – вспышка и облако густого белого дыма. Интересна в данном случае роль воды, которая в реакцию не вступает, а лишь ускоряет её в несколько раз. Но учти, что приготовленная смесь для опыта должна быть полностью использована в самое ближайшее время, так как она способна самовоспламеняться.
ВОДОРОД И КУРИНОЕ ЯЙЦО
Гибель дирижабля «Гинденбург» в 1937 году привела к тому, что мы перестали использовать самое лёгкое вещество во Вселенной в качестве основы для передвижения авиатранспорта. А всё потому, что H2 очень охотно взрывается. А проиллюстрирует это опыт с воздушным шариком. Наверное, многие на уроках приходили в восторг, когда в пробирку с кислотой бросали кусочек цинка, а потом детонировали выделяющийся газ горящей лучиной. Хлопок сопровождался лающим звуком – это признак микровзрыва смеси водорода и воздуха (гремучий газ).
Наш опыт подобен, но проводить его нужно с запасом изрядной доли отваги. Для его реализации потребуется: • соляная кислота (HCl) • гранулированный цинк (Zn) • плоскодонная колба с длинным узким горлышком • нитки • воздушный шарик В колбу налей кислоту – около 30-40 милиграмм, затем отправь туда же цинк и быстро надень на горлышко воздушный шарик. Так ты инициируешь химическую реакцию по схеме:

Выделяющийся водород надует шарик. Когда он достигнет размеров небольшой дыни, то быстренько сними его с колбы и плотно завяжи. Если удалось собрать достаточно газа, то шарик будет тянуть к потолку, в этом случае необходимо его «заякорить» чем-то тяжёлым.
Теперь зажги лучину и поднеси к водородному шарику. Только не пугайся, потому что моментально раздастся доволно громкий хлопок. Никакой опасности он не представляет, только лишь слегка давит на барабанные перепонки. В основе опыта лежит следующая реакция:
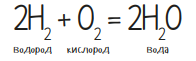
Некоторые опыты по химии тесно связаны с живой природой. Куриное яйцо может стать отличным биологическим объектом для исследования действия кислот. Для опыта «яйцо + кислота» потребуется концентрированная азотная кислота (HNO3) в объёме 50-60 милиграмм, стеклянный химический стакан и сырое куриное яйцо. Важно, чтобы диаметр стакана был больше яйца. Порядок действий очень прост: в резиновых перчатках налей кислоту в стакан, а затем просто опусти в него яйцо. Начнётся обильное выделение пены, что является признаком следующей реакции:
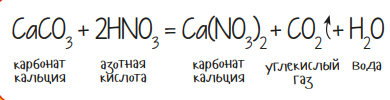
Наверное, ты уже догадался, откуда в исходных веществах уравнения появился мел или карбонат кальция (CaCO3)? Правильно, он входит в состав яичной скорлупы и активно реагирует с кислотой. Самое же интересное будет, если ты дождёшься полного растворения CaCO3, когда яйцо останется без скорлупы. Но оно не растечётся, а станет упругим! Это следствие денатурации (сворачивания) белка под действием концентрированной кислоты. Эластичным станет только тонкий наружный слой, внутри же яйцо по-прежнему сырое.
САМОЕ ВАЖНОЕ
Вся практическая химия очень интересна до тех пор, пока соблюдаются правила техники безопасности. Ни один даже самый захватывающий опыт не стоит травмированных глаз или обожжённой кожи. Поэтому все вышеописанные опыты проводить необходимо ИСКЛЮЧИТЕЛЬНО под руководством опытного учителя химии и в специальных условиях лаборатории. Начинающий химик-практик должен знать:
Глаза – это ключевой канал получения информации для человека. Поэтому защитные очки или лучше маска – главные атрибуты любого экспериментатора.
Пиротехнические опыты следует проводить с минимальными массами реагирующих веществ. Поджигать смеси желательно не спичками, а лучиной.
Опыты с горючими веществами нужно проводить в хорошо проветриваемом помещении и желательно, чтобы была вытяжка. В шаговой доступности обязателен исправно работающий огнетушитель
Растирать в ступке реактивы надо с умом! Аккуратность и осторожность – вот главные твои спутники в этом кропотливом деле. Особенно опасны смеси окислителей и восстановителей. Помни, что именно на этом этапе происходит наибольшее количество несчастных случаев!
Работу, связанную с опасностью воспламенения, вспышки или взрыва, как правило, надо выполнять стоя. При работе с такими веществами недопустимо даже на короткое время оставлять рабочее место без присмотра.
Помни, что вероятность поражения осколками и взрывной волной снижается пропорционально квадрату расстояния. Поэтому, чем дальше ты находишься от потенциального источника взрыва, тем лучше.
В помещении лаборатории воспрещается: а) загромождать и захламлять коридоры и проходы, а также подходы к средствам тушения; б) сушить какие-либо предметы на отопительных приборах; в) хранить вещества неизвестного происхождения и без этикеток.
Для проведения пиротехнических опытов в лаборатории каждый учащийся должен иметь защитный халат, очки или маску и стойкие к химии перчатки.
Тебе скучно на уроках химии? Не унывай! Мы подготовили рецепты захватывающих и в чём-то даже опасных опытов, которые можно осуществить в любой химической лаборатории. Для их реализации нужен опытный педагог, минимальный набор химических реактивов, строгое соблюдение техники безопасности и, конечно, чуточка отваги.
ШУМ, ДЫМ ОГОНЬ
На данный момент все сходятся во мнении, что это вещество было впервые получено в древнем Китае и использовали его для отпугивания злых духов. Сейчас мы знаем его как чёрный или дымный порох. В оружейной промышленности он почти не используется, но его можно отлично применять на уроках химии или занятиях профильного кружка.
Чтобы приступить к делу, подготовь набор. Понадобятся ступка с пестиком, железная или керамическая тонкостенная чаша, лучина, спички, калиевая селитра или нитрат калия (KNO3), порошкообразная сера (S) и активированный уголь (C).
И не забудь запастись весами с точностью до 0,1 грамм. Итак, взвесь исходные ингредиенты: • 7,5 грамм нитрата калия • 1 грамм серы • 1,5 грамма угля
Всё это тщательно перетри в ступке до порошкообразного состояния. Помни, чем мельче будет помол, тем зрелищнее будет демонстрация. Теперь щепотку полученного пороха высыпь в керамическую или металлическую посуду и подожги лучиной (не спичками!). Смесь замечательно воспламеняется, образуя облако густого дыма. Общий принцип реакции описывается сложным уравнением:

Как видно, три исходных вещества в доли секунды превращаются сразу в семь, причём четыре из них – газы. В этом и есть истинная взрывная сущность пороха – мгновенно расшириться в объёме в тысячу раз. Эта энергия столетиями заставляла вылетать снаряды и пули из стволов, дробила горную породу и меняла русла рек. В ходе войн «чёрный» порох, как ни одно другое вещество, перекраивал карту мира.
Парадоксальным на первый взгляд кажется опыт, в котором вспыхивает огонь… от капли воды. Эта увлекательная демонстрация возможна при наличии пипетки, сухой ступки с пестиком, фарфоровой или жестяной чаши, аммиачной селитры (NH4NO3), хлорида натрия (NaCl) или хлорида аммония (NH4Cl), порошка цинка (Zn) и воды. Позаботься, чтобы все реактивы и оборудование были абсолтно сухими, так как малейшая сырость может всё испортить. В фарфоровую ступку помести: • 4 грамма нитрата аммония (NH4NO3) • 1 грамм поваренной соли (NaCl) • 10 грамм порошкообразного цинка Если для пущего эффекта нужно очень много дыма, то поваренную соль можешь заменить на хлорид аммония. После тщательного перетирания щепотку (не больше!) смеси помести в фарфоровую или жестяную чашу и из пипетки добавь 2-3 капли воды. Пара секунд – вспышка и облако густого белого дыма. Интересна в данном случае роль воды, которая в реакцию не вступает, а лишь ускоряет её в несколько раз. Но учти, что приготовленная смесь для опыта должна быть полностью использована в самое ближайшее время, так как она способна самовоспламеняться.
ВОДОРОД И КУРИНОЕ ЯЙЦО
Гибель дирижабля «Гинденбург» в 1937 году привела к тому, что мы перестали использовать самое лёгкое вещество во Вселенной в качестве основы для передвижения авиатранспорта. А всё потому, что H2 очень охотно взрывается. А проиллюстрирует это опыт с воздушным шариком. Наверное, многие на уроках приходили в восторг, когда в пробирку с кислотой бросали кусочек цинка, а потом детонировали выделяющийся газ горящей лучиной. Хлопок сопровождался лающим звуком – это признак микровзрыва смеси водорода и воздуха (гремучий газ).
Наш опыт подобен, но проводить его нужно с запасом изрядной доли отваги. Для его реализации потребуется: • соляная кислота (HCl) • гранулированный цинк (Zn) • плоскодонная колба с длинным узким горлышком • нитки • воздушный шарик В колбу налей кислоту – около 30-40 милиграмм, затем отправь туда же цинк и быстро надень на горлышко воздушный шарик. Так ты инициируешь химическую реакцию по схеме:

Выделяющийся водород надует шарик. Когда он достигнет размеров небольшой дыни, то быстренько сними его с колбы и плотно завяжи. Если удалось собрать достаточно газа, то шарик будет тянуть к потолку, в этом случае необходимо его «заякорить» чем-то тяжёлым.
Теперь зажги лучину и поднеси к водородному шарику. Только не пугайся, потому что моментально раздастся доволно громкий хлопок. Никакой опасности он не представляет, только лишь слегка давит на барабанные перепонки. В основе опыта лежит следующая реакция:
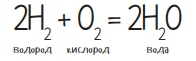
Некоторые опыты по химии тесно связаны с живой природой. Куриное яйцо может стать отличным биологическим объектом для исследования действия кислот. Для опыта «яйцо + кислота» потребуется концентрированная азотная кислота (HNO3) в объёме 50-60 милиграмм, стеклянный химический стакан и сырое куриное яйцо. Важно, чтобы диаметр стакана был больше яйца. Порядок действий очень прост: в резиновых перчатках налей кислоту в стакан, а затем просто опусти в него яйцо. Начнётся обильное выделение пены, что является признаком следующей реакции:
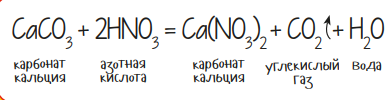
Наверное, ты уже догадался, откуда в исходных веществах уравнения появился мел или карбонат кальция (CaCO3)? Правильно, он входит в состав яичной скорлупы и активно реагирует с кислотой. Самое же интересное будет, если ты дождёшься полного растворения CaCO3, когда яйцо останется без скорлупы. Но оно не растечётся, а станет упругим! Это следствие денатурации (сворачивания) белка под действием концентрированной кислоты. Эластичным станет только тонкий наружный слой, внутри же яйцо по-прежнему сырое.
САМОЕ ВАЖНОЕ
Вся практическая химия очень интересна до тех пор, пока соблюдаются правила техники безопасности. Ни один даже самый захватывающий опыт не стоит травмированных глаз или обожжённой кожи. Поэтому все вышеописанные опыты проводить необходимо ИСКЛЮЧИТЕЛЬНО под руководством опытного учителя химии и в специальных условиях лаборатории. Начинающий химик-практик должен знать:
Глаза – это ключевой канал получения информации для человека. Поэтому защитные очки или лучше маска – главные атрибуты любого экспериментатора.
Пиротехнические опыты следует проводить с минимальными массами реагирующих веществ. Поджигать смеси желательно не спичками, а лучиной.
Опыты с горючими веществами нужно проводить в хорошо проветриваемом помещении и желательно, чтобы была вытяжка. В шаговой доступности обязателен исправно работающий огнетушитель
Растирать в ступке реактивы надо с умом! Аккуратность и осторожность – вот главные твои спутники в этом кропотливом деле. Особенно опасны смеси окислителей и восстановителей. Помни, что именно на этом этапе происходит наибольшее количество несчастных случаев!
Работу, связанную с опасностью воспламенения, вспышки или взрыва, как правило, надо выполнять стоя. При работе с такими веществами недопустимо даже на короткое время оставлять рабочее место без присмотра.
Помни, что вероятность поражения осколками и взрывной волной снижается пропорционально квадрату расстояния. Поэтому, чем дальше ты находишься от потенциального источника взрыва, тем лучше.
В помещении лаборатории воспрещается: а) загромождать и захламлять коридоры и проходы, а также подходы к средствам тушения; б) сушить какие-либо предметы на отопительных приборах; в) хранить вещества неизвестного происхождения и без этикеток.
Для проведения пиротехнических опытов в лаборатории каждый учащийся должен иметь защитный халат, очки или маску и стойкие к химии перчатки.





