О зависимости свойств элементов от собственных атомных масс знали ещё в эпоху зарождения Вселенной, но многие века она оставалась тайной за семью печатями. И только в XIX веке в учёном мире начались активные попытки взломать Периодический закон. Как вы догадываетесь, главным «взломщиком» стал гениальный химик Дмитрий Иванович Менделеев.
Таблица имени Дёберейнер
Если бы немецкий химик Иоганн Дёберейнер довёл идею упорядоченности элементов до логического конца, тогда, возможно, Периодический закон носил бы его имя. Он одним из первых в начале XIX века пытался систематизировать пятьдесят пять открытых к тому времени элементов и объяснить различие в свойствах. Дёберейнер заметил, что бром (Br) по своим свойствам находится посередине между йодом (I) и хлором (Cl), и более того — атомная масса Br также является средним арифметическим атомных масс Cl и I. Такая же зависимость наблюдалась ещё в двух группах — кальций, стронций, барий и сера, селен, теллур. Подобные совпадения не могли быть случайными и Дёберейнер принялся искать подобные триады среди остальных известных элементов. Были открыты ещё пара «троек» — литий, натрий, калий и фосфор, мышьяк, сурьма.
ТРИАДЫ ДЁБЕРЕЙНЕРА
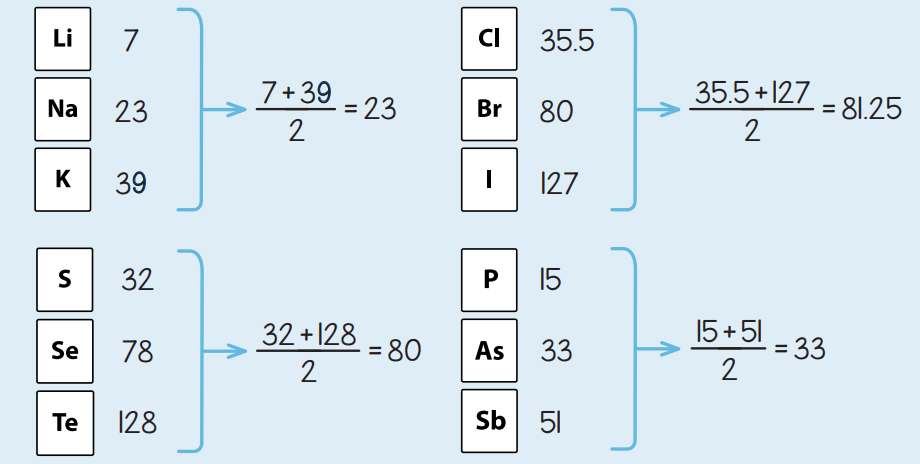
К 1829 году он опубликовал свои идеи, однако, научное сообщество отнеслось к ним очень скептически. Во-первых, казалось, что атомная масса не способна влиять на физические свойства элементов. Во-вторых, «триад Дёберейнера» было мало — остальные элементы не подчинялись этому правилу. В итоге первые попытки взлома Великого химического закона были отвергнуты, но фундамент для будущих открытий был заложен.
Отличительной характеристикой триад Дёберейнера был Ÿлемент в середине каждой триады, чья атомная масса является средним арифметическим двух крайних элементов
Музыка и объём атома
Октавы Ньюсленда вошли в историю химии, наверное, как самая курьёзная попытка объяснить устройство мира элементов. Что из себя представляли эти октавы? В 1864 году Джон Ньюсленд из Лондона предложил расположить известные на то время элементы по возрастанию атомных масс, поделив их на вертикальные столбы по семь элементов в каждом. И — о чудо, почти все элементы со сходными свойствами попадали в одни и те же горизонтальные ряды! В итоге получилась таблица, определённым образом описывающая периодическую зависимость свойств элементов от строения — она была прямым предшественником закона Менделеева. Открытую закономерность Ньюсленд назвал законом октав по аналогии с семью нотами, образующими музыкальную октаву, в которой каждая восьмая нота почти полностью повторяет первую и начинает новую октаву. Узнаёте? Английский химик практически подобрал необходимые инструменты для взлома, но для финального шага ему не хватило совсем чуть-чуть. Идею Ньюсленда учёные обсмеяли, указав, что не все ряды наполнены сходными элементами (а значит — выявленные совпадения случайны), а во время доклада в Лондонском химическом обществе ему саркастически предложили попробовать расположить элементы в порядке начальных букв их названий и обнаружить при этом какие-либо закономерности. Тем не менее, спустя много лет, в 1887 году Ньюсленд получил награду «за открытие периодического закона химических элементов». Парадокс в том, что пятью годами ранее точно такую же медаль с такой же формулировкой вручили русскому учёному Дмитрию Менделееву.
Немецкий химик Лотар Мейер решил измерить объёмы, которые занимают фиксированные веса различных элементов — тут он и наткнулся на золотую жилу химии. Мейер расположил полученные значения в порядке возрастания на двумерной плоскости графика, в котором на абсциссе возрастал атомный вес, а на ординате увеличивался атомный объём. Получилась кривая, которая достигала своих пиковых значений на щёлочных металлах — натрий, калий, рубидий и цезий. Кроме того, каждый спад и подъём в таком графике как раз и равнялся одному периоду в современной таблице элементов. Фактически Мейер к 1870 году создал аналог периодической таблицы, только в виде двумерного пилообразного графика. Интересно, что вторые и третьи периоды содержали элементы из октав Ньюсленда. Как видно, идея периодичности свойств элементов витала в воздухе в XIX веке.
Предсказатель элементов
Дмитрий Менделеев знал о работах своих предшественников и в разработке Периодического закона учёл их недочёты. Он не стал рисовать график, как Мейер, и отказался от строго равных периодов, на которых так настаивал Ньюсленд. В итоге 1869 год, когда 35-летний Менделеев опубликовал свои идеи в «Журнале русского химического общества», стал триумфальным для химии. Он разместил элементы в порядке возрастания атомных масс с одинаковыми валентностями в столбцы, но не стал бездумно подгонять факты под теорию и расположил некоторые элементы с большим весом перед более лёгкими. Так, например, теллур с атомной массой 127,6 оказался перед йодом (атомная масса — 126,9). И самым смелым стало заявление Менделеева о том, что в его таблице имеются «белые пятна», являющиеся ещё не открытыми элементами! Это, безусловно, всколыхнуло научное сообщество того времени. Названия Менделеев будущим элементам присваивал с приставкой «эка» (на санскрите значит «одно, следующее») — экаалюминий, экакремний, экабор. В 1870 году учёный так предсказывал свойства экаалюминия (Еа): «Свойства этого металла во всех отношениях должны представлять переход от свойств алюминия к свойствам индия, и очень вероятно, что этот металл будет обладать большей летучестью, чем алюминий, а потому можно надеяться, что он будет открыт спектральным исследованием».
Через пять лет Поль Эмиль Лекок де Буарбордан обнаружил в спектре минерала цинковой обманки яркую фиолетовую линию, никогда ранее не встречающуюся — им оказался предсказанный экаалюминий, названный позднее галлием! Экабор (Eb), по мнению Менделеева, должен обладать атомной массой около 44, иметь оксид формулой R2 O3 , а внешний вид соли — бесцветный. Обратитесь к Периодической таблице, и вы узнаете в этом элементе скандий, открытый в 1879 году шведом Ларсом Фредериком Нильсоном. Но самое подробное предсказание первооткрыватель Периодического закона совершил с экасилицием (Es), указав атомную массу в 72, формулу оксида RO2 с удельной массой 4,7, а также рассчитал состав хлорида RCl4 .
Менделеев пошёл дальше и упомянул о двойственной природе химических свойств неоткрытого элемента и о способности создавать металлоорганические соединения. Догадались, о чём идёт речь? Конечно, о германии, открытом ещё при жизни учёного немецким химиком Клеменсом Винклером в 1888 году. Уже после смерти Менделеева были открыты также предсказанные им гафний (двицирконий), рений, франций и радий. И для всех них Великий Предсказатель оставил свободные места. Дальше больше — уверенный в своей правоте Менделеев стал исправлять атомные массы известных на то время элементов. Первым стал бериллий — у него масса атома сразу снизилась с 14 до 9,4, что не нарушало стройную структуру Периодической таблицы элементов. Кроме этого, были уточнены атомные массы ещё восьми жителей таблицы и в соответствии с этим они получили свои законные места. Практическое подтверждение дерзких идей учёного пришло намного позже — например, титану скорректировали массу атома только в 1885 году, спустя пятнадцать лет.
Многоликая таблица
Потрясающие успехи Менделеева были отмечены на многих уровнях. В 1882 году совместно с Лотаром Мейером учёный получил престижную медаль Дэви «За открытие периодических соотношений атомных весов» от Лондонского королевского общества и, безусловно, вполне заслуживал молодую тогда Нобелевскую премию по химии. Как раз в начале XX века Периодический закон выдержал одно из серьёзнейших испытаний — открытие инертных газов. Аргон с гелием были в этом списке первыми и в таблице для них не оказалось мест. Их нулевая валентность, одноатомность молекулы очень затрудняла их расположение, что было принято научными оппонентами Менделеева на вооружение. Посыпались обвинения в ложности Периодического закона, но учёный очень изящно от них ушёл, просто создав особую нулевую группу элементов, куда и поместил неприкаянные элементы. В дальнейшем новые инертные газы пополнили список таблицы и стали главной подгруппой VIII группы. Периодический закон получил своё фундаментальное подтверждение и в начале прошлого века Д. И. Менделеева трижды номинировали на Нобелевскую премию — в 1905, 1906 и 1907 годах. В первых двух случаях более значимыми по мнению Шведской академии наук стали работы Адольфа фон Байера и Анри Муассан, в 1907 году, когда решение о вручение Дмитрию Ивановичу премии было практически принято, учёный ушёл из жизни.
На данный момент Периодическая таблица элементов существует в нескольких вариантах — короткопериодическая, длиннопериодическая и сверхдлинная. Короткая форма является классической, именно в таком виде учёный опубликовал её в 1871 году, а в 1989 году ИЮПАК (Международный союз теоретической и прикладной химии) отменил её, заменив длинной формой. В этой форме 18 групп, а ряды, подгруппы и семейства отсутствуют, что упрощает работу с ней. Сверхдлинная таблица неофициальна и состоит уже из 32 групп, в которой четырнадцать содержат всего по два элемента. Не только форма меняется, но и содержание! Совсем недавно под номерами 113, 115, 117 и 118 были торжественно внесены в состав таблицы нихоний, московий, теннесин и оганессий. И учёные из мировых центров синтеза новых элементов полны сил на новые свершения в поиске того самого конечного элемента периодического закона. Взлом периодического закона, как мы видим, в самом разгаре.
История Химической галактики
Джон Дрюри Кларк был первым, кто предложил новую спиралевидную диаграмму для Периодической системы химических элементов. Данная конструкция была опубликована журналом Life в 1949 году. В 1951-м художник Эдгар Лонгман адаптировал изображение Кларка, превратив овал в эллипс и наклонил его, добавив динамики. В свою очередь, писатель и академик Филипп Стюарт заметил, что дизайн Лонгмана напоминает спиральную галактику. Таким образом, первая версия химической галактики была опубликована в 2004 году. Химическая галактика пытается передать связь между чрезвычайно крошечным миром атомов и необъятностью звёзд, между которыми помещены элементы.






