Мы умеем уверенно переписывать ДНК животных, но вот генетически модифицированные люди до недавнего времени существовали только в научной фантастике. Всё изменилось в ноябре 2018 года, когда китайский учёный Цзянькуй Хэ объявил о рождении первых в мире девочек с отредактированным геномом.
ЛЕЧЕНИЕ ВПРОК
Генетические болезни принципиально отличаются от всех прочих тем, что их невозможно вылечить до конца. Бактерию можно убить, опухоль — вырезать, рану — зашить, но что делать со сломанным геном в каждой клетке организма?
Пока мы можем только компенсировать или смягчать проявление мутаций и генетических аномалий. Иногда этого достаточно, например, если сломанный ген работает только в одном органе, как бывает, скажем, при серповидноклеточной анемии. У больного повреждены только эритроциты, поэтому ему можно помочь, переливая кровь или пересаживая красный костный мозг. Но что делать, например, с муковисцидозом, при котором страдают одновременно все слизистые оболочки организма?
Хорошим решением такой проблемы была бы точечная починка генов в самом начале зародышевого развития, а идеальным — если бы гены были исправлены ещё до того, как оплодотворённая яйцеклетка начнёт делиться. Если на этой стадии вырезать или заменить поврежденный ген, то все клетки будущего организма окажутся здоровыми.
Учёные умеют чинить и менять гены в зародышах животных разными методами. Однако все они работают не очень изящно. Нужный ген вводят сразу в несколько зародышей и подсаживают их будущей матери в надежде на то, что хотя бы в одном из них произойдёт правильное встраивание или замена. Остальное потомство приходится отбраковывать. Но поскольку с людьми так поступить невозможно, для работы с человеческими генами требуются более совершенные инструменты генетической хирургии. И самый точный из них сегодня — CRISPR/Cas.
Муковисцидоз вызывается мутацией гена CFTR. Больные вынуждены каждый день проводить ингаляции, чтобы освободить легкие от мокроты. Учёные предложили таким же образом доставлять препарат, содержащий переносчик здоровой версии гена.

CRISPR-CAS9 — БАКТЕРИАЛЬНЫЙ МЕХАНИЗМ ЗАЩИТЫ
- 1. Вирус попадает в бактерию;
- 2. Бактерия записывает фрагмент его генома в свой CRISPR-участок ДНК;
- 3. Бактерия создаёт CRISPR-РНК — комплементарную копию вируса;
- 4. Как только вирус снова появляется в клетке, CRISPR-РНК прикрепляется к ферменту Cas9;
- 5. CRISPR-РНК соединяется с генетическим материалом вируса, а Cas его разрезает.
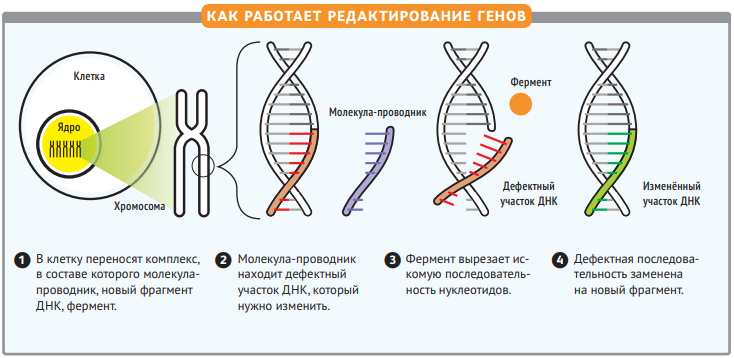
Генетические ножницы
Систему CRISPR/Cas мы подсмотрели у бактерий. А те, в свою очередь, «изобрели» её, чтобы бороться с вирусами. Как только внутрь бактерии попадает вирус, она записывает участок его генома в свою ДНК. Такой набор «особых примет» вирусов называют CRISPR. Затем бактерия создаёт комплементарную РНК-копию вируса и запасается белками-ферментами Cas. Как только вирус повторно оказывается в клетке, РНК-копия соединяется с генетическим материалом вируса, а Cas его разрезает. То есть система CRISPR/Cas работает как приобретённый иммунитет — убивает врагов, с которыми клетка уже знакома.
Этот же принцип можно использовать и в клетках человека. Для этого в них вводят белок Cas9 и направляющую РНК, которая комплементарна последовательности гена-мишени. РНК связывается с геном, а Cas9 распознаёт комплекс ДНК-РНК и вносит разрыв в ДНК, вырезая участок целиком.
Дальше у клетки есть два пути. Первый — сомкнуть концы разреза и остаться без гена или его участка. Второй — воспользоваться второй копией гена с другой хромосомы и застроить разрыв по его шаблону. Кроме того, учёные могут подсунуть клетке «правильную» последовательность ДНК и понадеяться, что она использует её как шаблон — таким образом ген можно «переписать», то есть отредактировать.
ПЕРВЫЕ ШАГИ
Цзянькуй Хэ не был первым, кто придумал использовать CRISPR/Cas9 на эмбрионе человека. Эксперименты такого рода начались ещё в 2015 году — что характерно, тоже в Китае. Исследовали тогда пробовали вводить молекулярные ножницы в оплодотворённую яйцеклетку и проверяли, работают ли они в делящемся зародыше. У них действительно получилось вырезать из ДНК эмбрионов отдельные гены. Проблема состояла в том, что зародыши после этого получались мозаичными: часть клеток была отредактирована, а другая часть — нет. В США в то время действовал запрет на эксперименты по вмешательству в ДНК эмбрионов.
В 2017 году его сняли, и американская группа тут же опубликовала результаты своей работы в противовес китайцам. В ней, например, учёные выяснили, что CRISPR/Cas9 гораздо удобнее вводить в яйцеклетку в процессе искусственного оплодотворения, прямо вместе со сперматозоидом. Это помогло снизить уровень мозаицизма в зародышах.
Но несмотря на успех своего эксперимента, американцы не собирались подсаживать полученные эмбрионы будущим матерям. Дело в том, что эффективность их метода оказалась далека от 100 % — лишь 42 из 58 экспериментальных зародышей получилось отредактировать целиком и без побочных эффектов. После этого научное сообщество решило, что технология хоть и полезная, но пока сырая и нуждается в доработке.
Хэ Цзянькуй — китайский биолог и биофизик, 26 ноября 2018 года заявивший, что ему удалось создать первых в мире людей с искусственно изменёнными генами
СКАНДАЛ В ГОНКОНГЕ
В ноябре 2018 года в Гонконге должен был собраться международный саммит, посвящённый редактированию генома человека. Специалисты из разных стран планировали обменяться опытом в работе с CRISPR/Cas9 и договориться, когда и кому можно разрешить применять эту систему на практике. Но оказалось, что один из них — Цзянькуй Хэ — её уже применил.
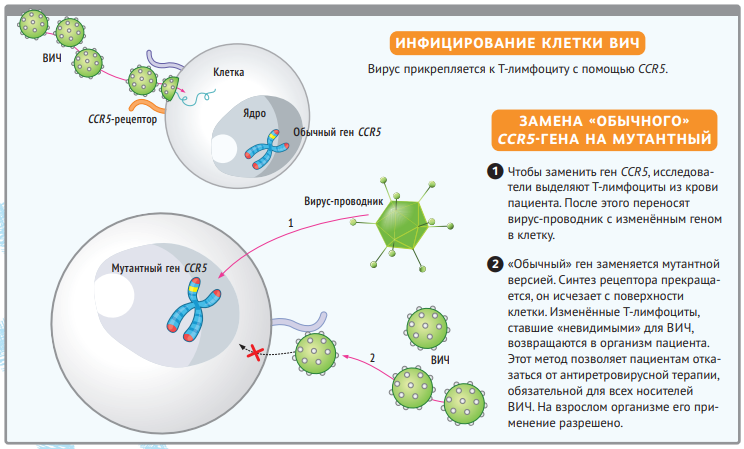
Хэ заявил, что сделал несколько детей от ВИЧ-положительных родителей устойчивыми к этой инфекции. Дело в том, что вирус иммунодефицита человека попадает в клетки с помощью рецептора CCR5 на поверхности лимфоцитов. Хэ сообщил, что он вырезал кусок гена, который кодирует CCR5, из ДНК зародышей и тем самым лишил вирус возможности заражать клетки. Также он рассказал, что на свет уже появились два ребёнка с отредактированным геномом — близняшки Лулу и Нана. Ещё одна женщина, по его словам, должна была родить весной-летом 2019 года. Забегая вперёд, скажем сразу, что никаких открытых данных о судьбе этих детей нет, поэтому невозможно проверить, правда ли они существуют и как складывается их жизнь.
Зато известно, как сложилась жизнь самого Хэ и его коллег после скандального выступления на саммите. Сначала дерзкого учёного настигла долгожданная слава: о нём писали журналисты по всему миру, а учёные до сих пор обсуждают детали и последствия его эксперимента.
Затем наступило возмездие: китайские власти объявили его исследования незаконными и запретили ему их продолжать. Позже его поместили под домашний арест, а в декабре 2019 года суд приговорил Хэ и его коллег к нескольким годам тюрьмы и сотням тысяч долларов штрафа и пожизненно лишил их лицензии на медицинскую деятельность.
В ЧЁМ ПРОБЛЕМА
История Цзянькуя Хэ наглядно показывает, насколько мир оказался не готов к генетической модификации людей. Технология, которая в фантастических романах выглядит простой и естественной, на деле столкнулась сразу со множеством трудноразрешимых проблем.
1. ГДЕ ПРАВДА?
Информация об экспериментах Хэ и его команды до сих пор нигде полностью не опубликована. Его статью не принял ни один из журналов, в которые он посылал рукопись. Даже сайт bioRxiv, с помощью которого учёные делятся «сырыми» данными, отказался вывешивать работу по генетической модификации детей. Поэтому до недавнего времени судить о том, что на самом деле сделал Хэ, можно было только по слайдам его презентации с того самого саммита в Гонконге. Позже в открытом доступе появились фрагменты оригинальной статьи учёного. Поэтому пока научному сообществу сложно оценить, справился ли Хэ со своей задачей и что из этого получилось.
2. ОПРАВДАН ЛИ РИСК?
Редактирование генома — это крайняя мера, сложная и рискованная. Поэтому нужно быть уверенным, что это действительно необходимо. Хэ аргументировал свою позицию так: в Китае распространена ВИЧ-инфекция. У девочек ВИЧ-отрицательная мать и ВИЧ-положительный отец, что повышает их риск заболеть. Редактирование должно сделать их устойчивыми.
Но оппоненты Хэ не считают, что это достаточное основание для вмешательства в ДНК. Если в семье инфицирован только отец, то достаточно просто «отмыть» его сперматозоиды от вирусных частиц перед искусственным оплодотворением — и дети не заболеют. Тогда возникает другой вопрос: в каких ситуациях вмешательство в геном вообще оправдано?
Российский биолог Денис Ребриков летом 2019 года заявил, что готов идти по стопам Хэ, с той лишь разницей, что будет делать это в открытую. Сейчас он ищет пары глухих людей, которые хотели бы завести слышащего ребёнка. Западные учёные его критикуют и отмечают, что глухота — недостаточно серьёзный диагноз. Какой же тогда считать серьёзным? С одной стороны, логично предположить, что обоснованием для редактирования будет какая-нибудь тяжёлая генетическая болезнь, которая всерьёз осложняет жизнь, вроде того же муковисцидоза или спинальной мышечной атрофии. С другой стороны, люди с такого рода болезнями редко доживают до репродуктивного периода или неспособны выносить ребёнка.
В тех же случаях, когда они доживают, заводят семью и готовы принести потомство, это, как правило, означает, что их болезнь поддается лечению или компенсации. А тогда непонятно, так ли их детям необходимо редактирование; возможные риски от редактирования начинают перевешивать последствия от естественного зачатия и родов. В общем, учёные так и не договорились о том, кого действительно нужно генетически редактировать.
3. ДОБИЛСЯ ЛИ ХЭ СВОЕЙ ЦЕЛИ?
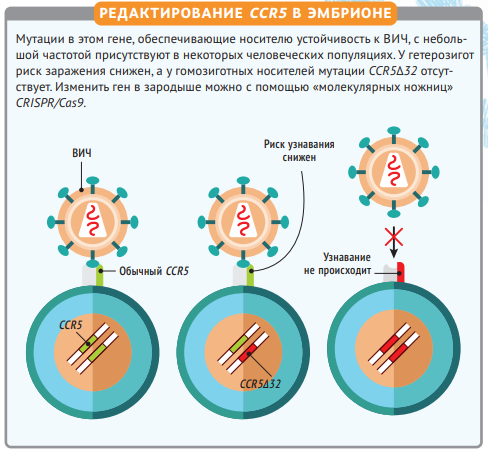
Вне зависимости от того, оправдан ли риск в экспериментах Хэ, оценивать их будут в первую очередь по качеству работы. И вот к нему есть большие претензии — даже у тех, кто видел только слайды с его презентации. Китаец пытался не просто вырезать кусок гена из ДНК эмбрионов, он поставил целью воспроизвести естественную мутацию CCR5Δ32, которая встречается у нескольких процентов европейцев и делает их устойчивыми к ВИЧ. Но результаты генетического анализа отдельных клеток из организма Лулу и Наны показывают, что разрез вышел неаккуратным.
У одной из них отредактирована только одна из копий гена; у другой в двух копий мутации оказались разными. Кроме того, по меньшей мере одна из девочек получилась мозаичной — не все клетки в её теле отредактированы одинаково. Это могло произойти, если система CRISPR/Cas9 начала действовать уже после первого деления оплодотворённой яйцеклетки и попала только в одну клетку из двух. Но раз не все клетки тела несут мутацию, мы не можем быть уверенными в том, что организм действительно устойчив к ВИЧ.
Настоящие имена близняшек, как и другая информация об их внешности и родителях, общественности неизвестны, им дали псевдонимы Лулу и Нана

ЕСТЕСТВЕННАЯ МУТАЦИЯ CCR532 В МИРЕ
Она встречается крайне редко: менее чем у 1 % населения планеты и преимущественно в Северной Европе. По одной из гипотез, такое распределение связано с несколькими эпидемиями в Средневековье. Изменённый ген увеличивал сопротивляемость к инфекции, носители смогли выжить и передать его своим детям. Так мутация закрепилась в регионе. Однако даже у «полезной» мутации есть оборотная сторона. Учёные связывают отсутствие рабочей копии этого гена с повышенной восприимчивостью к гриппу и меньшей продолжительностью жизни, поэтому суммарная польза от мутации под вопросом.
4. ЧЕМ РИСКУЮТ ПАЦИЕНТЫ?
Первое — это «офтаргет-эффекты», то есть следы нецелевого редактирования. Как бы точно мы ни подобрали направляющую РНК, всегда есть шанс, что она прилипнет к какому-то другому участку ДНК, и Cas9 внесёт туда незапланированный разрез. И если этот участок окажется внутри другого гена, то зародыш может получить новую генетическую патологию. Хэ утверждает, что не обнаружил в геноме Лулу и Наны следов нецелевого редактирования. Но и этого мы не можем знать наверняка: современные технологии прочитывания ДНК несовершенны, и некоторые поломки легко могут проскочить незамеченными.
Второе — ущерб от удаления гена-мишени. Не все мутации однозначно вредны или полезны, и CCR5Δ32 — хороший тому пример. Ген CCR5 вроде бы не является жизненно необходимым. Однако то и дело появляются данные о том, что мутация CCR5Δ32 не безобидна. Например, говорили, что носители мутации якобы раньше умирают (впрочем, эти сведения недавно опровергли). Или что они чаще страдают от некоторых вирусов и шизофрении. Или даже что они в среднем обладают более высокими умственными способностями. Если выяснится, что это действительно так, то Хэ окажется в ещё более неприятной ситуации. Несмотря на то, что он выбрал для редактирования ген, который не несёт никаких дополнительных функций, не исключено, что он неумышленно «усовершенствовал» своих экспериментальных детей.
5. КТО РЕШАЕТ?
Ситуация с редактированием зародышей — уникальная этическая и юридическая проблема. Дело в том, что мы редактируем ещё не зачатого человека, то есть лечим ещё не существующую болезнь. Но имеют ли родители право решать за человека, каким ему быть на всю оставшуюся жизнь (ведь «откатить назад» генетические изменения он уже не сможет)?
Есть и другая проблема: когда научное сообщество позволит себе решить, что мир готов к генетическому редактированию? Как точно мы должны уметь читать геном будущего ребенка, чтобы не пропустить ошибку? Насколько много мы должны знать о своих генах, чтобы случайно не сделать будущего ребенка более умным, тревожным или агрессивным? Когда мы разрешим себе вмешиваться в геном и судьбу ещё не родившихся людей?
На эти вопросы до сих пор нет ответа. Цзянькуй Хэ сидит в тюрьме. Денис Ребриков ищет первых пациентов. Международные комиссии пытаются придумать правила, по которым будут регулировать генетическую модификацию эмбрионов. И пока этот процесс идёт, многие страны мира запретили применять редактирование зародышей, кроме как в исследовательских целях. Генетическая модификация детей пока остаётся нелегальной везде, где есть достаточно ресурсов, чтобы её проводить.
Тем не менее вслед за технологией всегда приходят те, кто готов применить её на практике. А за ними те, кто готов за это заплатить. И чаще всего они хотят именно того, чего сильнее всего опасаются учёные. Так, в США уже начали появляться стартапы, которые предлагают родителям создать «дизайнерского ребёнка» — то есть выбрать из эмбрионов самого «удачного» или отредактировать тех, что получились. И коль скоро технология уже известна, а первый камень положен (пусть и ценой свободы и карьеры Цзянькуя Хэ), едва ли её можно будет остановить, какие бы запретительные законы мы ни принимали.